Supporting materials
Dióxido de carbono – información adicional (Word)
Dióxido de carbono – información adicional (Pdf)
Download
Download this article as a PDF

Traducido por José Villanueva Santiago. Marlene Rau presenta algunhas actividades gasosas e divertidas, que inclúen ó dióxido de carbono, desenvolvidas pola Chemol e Science on the Shelves.

O dióxido de carbono (CO2) non é só un dos gases de efecto invernadoiro máis importantes, atópase ó arredor de nós: no aire que respiramos (0,0388% vol.); no aire que expiramos (4% vol.); en bebidas carbonatas, en galletas, que aumentan de volume debido ó CO2 producido polos fermentos, e cando se queiman sustancias orgánicas como parafina, papel, madeira, ou aceite. En forma de líquido emprégase en extintores de incendios e coma refrixerante na industria alimentaria (por exemplo, para almacenar e transportar xeado).
A exposición a concentracións elevadas de CO2 pode cegar a ser perigosa para os seres humanos e outros animais, pero tamén e unha fonte de vida: durante a fotosíntese, as plantas utilizan o CO2 e a luz para producir azúcares, almidón, graxas e proteínas así como o osíxeno que nos necesitamos para sobrevivir.
As seguintes actividades educativas procedentes de Chemolw1 e Science on the Shelvesw2 (ver recadro) acercanlle ós nenos da ensinanza primaria este importante gas. Para asegurar o éxito das actividades propostas, son necesarios coñecementos previos sobre química, importancia fixiológica, a detección e comportamento do CO2 os cales, están disponibles na sección de recursosw3.
Nota: as cantidades de dióxido de carbono producidas nestas actividades non son o suficientemente elevadas como para ser perigosas.

Cando se engade auga a un comprimido efervescente ou levadura artificial, formánse barbullas: serrase un gas. Este gas pode ser utilizado para inflar un globo sen ter que soplr un mesmo. Que tipo de gas é? Recollámolo e analicémolo.

Os seis primeiros pasos son comúns a ambas actividades – polo que existen dúas opcións para proceder.
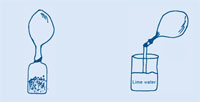
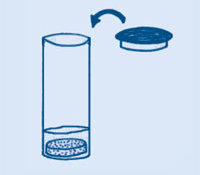
Cando o globo deixa de inflarse, prema o pescozo do globo e retorzao de modo que o gas non poida escapar, e quite o da botella.
Se a auga de cal cegase a poñerse en contacto cos ollos, laveos inmeditamente con auga. Vexa tamén a nota xeral de seguridade.
A proba da auga de cal para detectar CO2 foi desenvolvida polo químico Joseph Black (1728-1799). Ambos morteiro de cemento e conteñen hidróxido de calcio (Ca(OH)2). Cando o CO2 se engade a unha disolución acuosa de Ca(OH)2, prodúcense partículas moi pequenas de carbonato de calcio (CaCO3) que é o que fai que a auga de cal se turbe.
De onde ven o noso CO2? Tanto a levadura artificial coma os comprimidos efervescentes conteñen bicarbonato de sodio (NaHCO3) e un ácido sólido (coma os cristais de ácido cítrico ou de fosfato monocálcico). En contacto coa auga, o bicarbonato de sodio e o ácido reaccionan un co outro, formando auga e CO2. Este gas é o que forma as burbullas cando un comprimido efervescente se disolve; é tamén o que fai que os pasteis de crezan.
A candea debe deixar de arder, porque o (CO2) afoga a chama.
Outra vez, a chama se extigue, mostrando que fomos quen de vertelo gas dun vaso cara o outro, coma se tratara dun líquido. Este feito demostra que o gas e máis pesado co aire.
Chemolw1 é un proxecto da University of Oldenburg, Alemaña, para poñer en contacto ós nenos da escola primaria coa química. O equipo que inclúe mestres en formación e que é dirixido pola Dra. Julia Michaelis, ofrece obradoiros para nenos que tratan do lume, a terra, o aire e a auga, así coma a formación de mestres de ensinanza primaria.
Outras actividades sobre o dióxido de carbono de Chemol inclúen construir un extintor de lume baseado no CO2, experimentar con bebidas carbonatas, medila cantidade de gas que é xerada por unha pastilla efervescente e probalo efecto da temperatura na solubilidade do CO2 na auga. Os detalles poden atoparse na páxina web de Chemolw1.
Science on the Shelves é unha páxina webw2 que proporciona instruccións para un amplo rango de experimentos simples que utilizan alimentos e outros productos do supermercado, dirixido a nenos de 6 a 11 anos, os seus mestres e familias. O proxecto, que está localizado en UK e está coordinado polo Dr. Nigel Lowe, xorde da colaboración entre a University of York e a Engineering and Physical Sciences Research Council. Se tes ideas para grandes experimentos Nigel está esperando saber de ti.
Mestura 3 culleradas de bicarbonate sódicoe unha cullerada de cristáis de ácido cítrico (grao alimenticio). Para melloralo sabor, engade ou ben 2-4 culleradas de azucre finamente dividido ou unha cullerada de xelatina instantánea eunha cullerada de azucre. O teu sorbete está preparado para saborear.
Os cristais de ácido cítrico disólvense na lengua e reaccionan co bicarbonato sódico. ISto xera barbullas, producindo a sensación de efervescencia na lengua. Para facer unha bebida burbulleante mistura o sorbete con auga.
Os foguetes e os explisivos traballan xerando enormes cantidades de gas en moi pouco tempo. Ti podes crealos teus propios foguetes empreñando ácido cítrico e bicarbonato sódico ou pastillas efervescentes.
Os seguintes experimentos producen proxectis de elevada velocidade. Siga tódalas indicacións de seguridade e poña lentes de protección. Realice tódolos experimentos nun espacio aberto, xa que pode cusar danos no mobiliario. Besase tamén a nota xeral de seguridade.
Non permita nunca que ninguén albisque por riba do canón cando estea “cargado”. Se fallara (coma ocorre as veces se a tapa non pecha herméticamente), quite a tapa con moito coidado, mantendo a súa cara ben lonxe e apartada.

Cando os cristais de ácido cítrico e bicarbonato de sodio se disolven na auga, reaccionan un co outro para producir dióxido de carbono gasoso. Os comprimidos efervescentes xa conteñen ambos os ingredientes (bicarbonato de sodio e un ácido), podendo reaccionar un co outro cando se engade auga. O gas resultante expándese, presionando as paredes e a tapa do canón. Cando a presión se fai máis forte que o punto máis feble da parede circundante (a tapa), o canón explota dramáticamente, coa tapa saíndo proxectada ata 5 m no aire, liberando o gas.
Cronometra canto tempo lle leva a tapa saír disparada e logo experimenta con cantidades: por exemplo, tentar que a tapa para saia disparada despois de exactamente 1 min.

O dióxido de carbono pode ser un perigo ó acumúlarse en concentracións suficientemente altas. Para contralar este e outros gases perigosos no lugar de traballo, EFDA-JETw4 emprega unha variedade de instrumentos, tanto de uso manual coma instalados en edificios, para detectar gases que reducen a concentración de osíxeno e poden así levar á asfixia. O control de gases inclúe non só dióxido de carbono e outros gases crioxénicos coma o helio, senon tamén o nitróxeno (utilizado para a extinción de lumes), hexafluoruro de xofre (SF6, un gas de illamento eléctrico) e do vapores de líquidos de refrixeración coma Galden ®. Antes de traballar en áreas onde estes gases son un perigo, o persoal debe comprobalaa instrumentación instalada ou solicitalo emprego dun instrumento portátil para confirmar que a atmófera é segura.
O dióxido de carbono tamén é un risco potencial a 350 km sobre a superficie da Terra – para os astronautas a bordo da International Space Station Estación Espacial Internacional (ISS), coma demostrou un esutdio realizado por unha colaboración entre European Space Agency (ESA)w5 e outros socios internacionais.
Cando os seres humanos respiran, consumen osíxeno e producen dióxido de carbono. Como resultado, en hábitats pechados, como os submarinos, avións e a ISS, os niveis de osíxeno pode caer e o dióxido de carbono podese acumular, poñendo en perigo a tripulación (coma se describe na película Apollo 13). Os niveis de ambos gases nestas localizacións deben ser regulados.
Na actualidade, a ISS utiliza un enfoque aberto: atrapar dióxido de carbono en trampas específicas para este gas (por exemplo, hidróxido de litio, LiOH, que se combina co CO2 para formar o carbonato de litio e auga), e transportando botllas de osíxeno dende a Terra. No futuro, a ISS pode utilizar un enfoque pechado de reciclaxe: recuperando O2 dende o CO2, utilizando técnicas físico-químicas (esencialmente “cortar” a parte do osíxeno da parte de carbono) ou algas ou outras plantas (fotosíntizadoras)
EFDA-JET e ESA son membros do EIROforumw6, o editor de Science in School.

Geyser provén da palabra geysa procedente do Nórdico Antigo , que significa, chorro. En primeiro lugar foi empregado para O Great Geysir, unha fonte termal no val do Haukadalur, en Islandia, que lanza auga a ferver ata 70 m de altitude no aire, o termo agora é usado en xeral para fontes con erupcións intermitentes de chorros de auga. Así coma existen géiseres alimentados por auga fervendo, hai tamén géiseres fríos, alimentados por CO2. Xordindo das profundidades da Terra, o gas acumúlase por debaixo do fondo dun depósito de auga subterránea e acumula presión. Esta presión libérase regularmente en forma dunha fonte de auga fría. Pode haber un máis preto da súa casa do que pensa – por exemplo, o Herl’any, na Eslovaquia, ou en Wallenborn de preto de Andernach, na Alemaña.
Se non, podes construír un por ti mesmo. Poña 200 ml de auga nun bote de plástico cun bico retráctil (por exemplo, un que contivo deterxente líquido, ver imaxe debaixo), engadir unha culler colmada chea de bicarbonato de sodio e mesturar ben.

Engadir preto de 35 ml xabón líquido e axitar de novo. Utilizando un funil engadir rápidamente tres culleres de té cheas de cristais de ácido cítrico. Moi rapidamente, presione o bico pechando este sobre a botella, axite brevemente e tire do bico cara arriba para abrila botella.
Unha fonte de escuma de ata 5 m de altura vai sair cara arriba. Alternativamente, pode esperar a que o bico se abra por si só. De calquera xeito, despois dun tempo curto, a presión se liberará e a fonte vai parar. Peche o bote, premendo o bico para abaixo; preto de 30 segundos máis tarde, a presión volverá a ser de novo o suficientemente elevada para comezalo géiser. Pode repetir isto varias veces.
Información xeral sobre o CO2 (PDF o formato Word®)
Historias reais sobre os efectos letáis do (PDF ou formato Word®)
de Vries T (2002) Vitamintabletten einmal anders. Chemkon 9(3): 144-146. doi: 10.1002/1521-3730(200207)9:3<144::AID-CKON144>3.0.CO;2-K
Johnson S (2008) Planting ideas: climate-change activities for primary school. Science in School 10: 55-63. www.scienceinschool.org/2008/issue10/psiclimate
Shallcross D, Harrison T (2011) Is climate change all gloom and doom? Introducing stabilisation wedges. Science in School 20: 60-64. www.scienceinschool.org/2011/issue20/wedges
Este artigo ofrece formas simples de desvelar os misterios da ciencia. Axuda a todos a comprender os fenómenos e feitos naturais, tanto cotiás (respiración) coma os eventuáis (actividade volcánica). Pode inspirar a clase a desenrrolar experiencias prácticas. Tanto a nivel global (cambio climático) coma a un nivel moito menor (experimentos), pode permitir que os alumnos entendan que os perigos existe e que é necesario tomar medidas para evitalos.
O artigo pode ser conectado a eventos ou fenómenos naturais locáis coma as erupcións volcánicas de Islandia ou piscinas xeotérmicas. Tamén pode contribuír a espertar unha conciencia máis ecolóxica. Pódense realizar conexións interdisciplinares, entre as cuestións ambientais e ecolóxicas en a química, a física, a bioloxía (respiración), as ciencias da terra, as matemáticas (medidas e proporcións) e a alfabetización (instrucións e normas).
Ós nenos pequenos encantaránlles os globos burbulleantes e os géiseres; Eu reservaría as actividades mási explosivas para os estudantes máis vellos.
Maria João Lucena, Portugal