Química de colores: reacciones redox con chupachups Teach article
Usa un chupachup para activar reacciones redox que cambian de color en esta actividad sencilla pero llamativa.
La enseñanza de las reacciones de oxidación y reducción (redox) forma parte de todos los planes de estudios de química en educación secundaria. En este artículo, exponemos una demostración con vistosos cambios de color para ilustrar una cadena de reacciones redox, en la que los electrones se transfieren entre diferentes compuestos e iones. La actividad es adecuada como demostración del profesor, o para que los estudiantes (según su edad y etapa educativa) la realicen ellos mismos.

IanRedding/Shutterstock.com
Agentes oxidantes y reductores
Una reacción redox es cualquier reacción química en la que una molécula, átomo o ion pierde o gana electrones, modificando su estado de oxidación. Un agente oxidante gana electrones (y se reduce en la reacción) y un agente reductor pierde electrones (y se oxida en la reacción). En este experimento, la glucosa del chupachup se utiliza como agente reductor. Cuando la glucosa se añade a la disolución que contiene iones OH– hay una variedad de semirreacciones. Entre otras, la principal es que el grupo aldehído de la glucosa cede electrones, dando lugar a grupo carboxílico (en forma de carboxilato por tratarse de medio básico):
–CHO + 3 OH– → –COO– + 2 H2O + 2 e–
(grupo aldehído) (grupo carboxílico, como carboxilato)
También, los grupos alcohol de la glucosa ceden electrones, formando grupo carboxílico (en el caso del alcohol primario) y grupos cetona (en el caso de alcoholes secundarios):
–C(H)(OH)– + 2OH– → –C(=O)– + 2H2O + 2e–
(alcohol secundario) (grupo cetona)
En nuestro experimento, la glucosa se añade a una disolución de permanganato de potasio junto con hidróxido de sodio (NaOH), de forma que electrones de la glucosa (C6H12O6) se traspasan inicialmente a iones permanganato (MnO4–). Los productos de la oxidación del azúcar reductor son principalmente ácido glucurónico (C6H10O7), además de algo de ácidos arabinónico (C5H10O6) y fórmico (CH2O2). Si el chupachup está hecho de fructosa, que es un isómero de la glucosa, el producto principal es el ácido fructónico (también C6H10O7 y con nº CAS 669-90-9).
En una serie de reacciones redox, los electrones se traspasan continuamente de la glucosa a compuestos sucesivos de manganeso. En cada paso de la cadena, se ve un cambio de color. El manganeso es ideal para este experimento, ya que tiene más estados de oxidación estables que cualquier otro metal de transición (de +2 a +7), cada uno con diferente color.
Puede que estés familiarizado con la demostración clásica del «camaleón químico»w1,de la que este experimento es una adaptación. En la versión original, comienzas con una disolución de permanganato de potasio y glucosa, que cambia de color al mezclarla con una espátula. Al usar el chupachup, la glucosa se agrega más gradualmente a la disolución, lo que hace que sea más fácil seguir los cambios de color. El uso de un pequeño agitador eléctrico favorece que el chupachup se agite más rápido que con la mano.
Materiales
Necesitarás los siguientes materiales (ver figura 1):
- Cristales de permanganato de potasio (KMnO4)
- Chupachup que contiene glucosa (u otro azúcar reductor, como la fructosa)
- 3–4 lentejas de hidróxido de sodio (NaOH) (0,5 g aproximadamente)
- 200 ml de agua destilada
- Matraz erlenmeyer o vaso de precipitados de 250 ml (de vidrio o de plástico)
- Cucharita y espátula
- Agitador eléctrico de mano, como algún espumador de leche (disponible en tiendas de utensilios de cocina)
- Cinta adhesiva

Marisa Prolongo
Nota de seguridad
Se debe usar bata de laboratorio, guantes y gafas de seguridad. Los profesores deben seguir las normas de prevención de riesgos y seguridad adecuadas a su entorno, en particular con respecto al uso de permanganato de potasio y la eliminación de la disolución resultante. Ver también la nota de seguridad general.
Procedimiento
La actividad es adecuada para realizar en una sesión de clase. El experimento dura solo unos 15 minutos y puede ser seguido de preguntas y discusión.
Los pasos son los siguientes:
- Llena el matraz erlenmeyer o vaso de precipitados con 200 ml de agua destilada.
- Añade las lentejas de NaOH y agita con la cucharita hasta que se disuelvan completamente.
- Usando la espátula, añade una pequeña cantidad de cristales de permanganato de potasio (no demasiado, o el color será demasiado oscuro para ver los cambios). Cuando el permanganato de potasio (KMnO4) se añade a la disolución alcalina de NaOH, se disocia en iones potasio (K+) y permanganato (MnO4–).
- Fija el palo del chupachup (ya sin la envoltura de plástico) a la varilla eléctrica del agitador con cinta adhesiva (ver la figura 1).
- Inserta el chupachup en la disolución y enciende el agitador para comenzar a mezclar.
A medida que el chupachup se disuelva en la disolución, observarás cambios de color para cada reacción redox. Los dos primeros suceden muy rápidamente (3-5 segundos), mientras que los cambios siguientes tardan un poco más. Los estudiantes pueden hacer fotos (por ejemplo, con la cámara de su teléfono móvil) en varios momentos para comparar y seguir mejor los cambios de color. Un vídeo de los autores donde se muestra el experimento está disponible en español w2.
¿Qué pasa en el experimento?
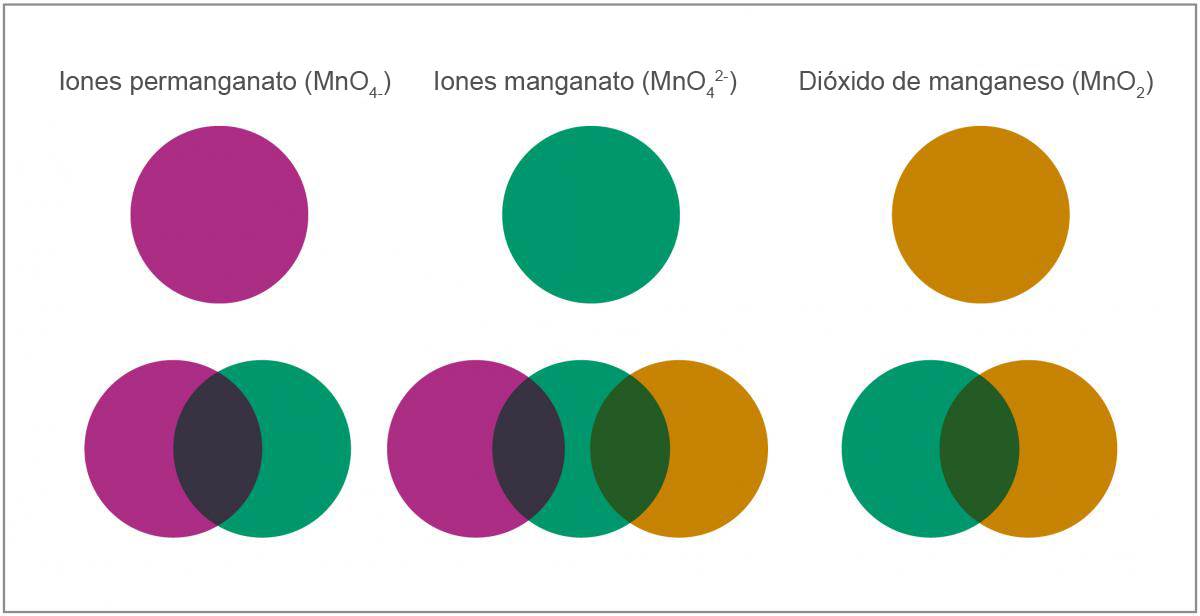
A medida que el chupachup se disuelve en la disolución que contiene iones de manganeso, se pueden distinguir al menos cinco colores diferentes (como se muestra en la figura 2), que corresponden a diferentes estados de oxidación de este metal.
- El primer color (púrpura) corresponde a iones permanganato (MnO4–). El manganeso tiene estado de oxidación +7.
- Los iones permanganato (MnO4–) se reducen después a iones manganato (MnO42–). El estado de oxidación del manganeso cambia de +7 a +6, y el color varía de púrpura a verde.MnO4–(aq) (púrpura) + e– → MnO42–(aq) (verde)Se produce una etapa azul intermedia entre los pasos 1 y 2. Una explicación es que la mezcla contiene tanto iones de permanganato (MnO4–) púrpura como de manganato (MnO42–) verde, que se combinan para dar una disolución azul. Otra explicación es que parte del permanganato se reduce a anión MnO43–, que tiene un estado de oxidación +5 para el manganeso y color azul.
MnO4–(aq) (púrpura) + 2e– → MnO43–(aq) (azul)
- Los iones manganato (MnO42–), que tienen un número de oxidación +6, se reducen aún más hasta dióxido de manganeso (MnO2), con estado de oxidación +4, provocando el cambio de color de verde a amarillo-marrón.MnO42–(aq) (verde) + 2 H2O(l) + 2e– → MnO2(s) + 4OH–(aq) (amarillo-marrón)
- Finalmente, cuando se incorpora más glucosa a la disolución, el dióxido de manganeso amarillo-marrón (MnO2) forma una suspensión coloidal en disolución alcalina que (si está bastante diluida) puede aparecer naranja.

Marisa Prolongo
Variación de color
Los colorantes alimentarios utilizados en los chupachups no tienen gran impacto en los colores que se ven en este experimento, pero hay otros factores que sí juegan un papel relevante. Una vez que se inician las reacciones, siempre hay coexistencia de iones en la disolución, lo que provoca unas mezclas de colores que no siempre son fáciles de interpretar (ver figura 3).
Otro factor es que el color de los iones de manganeso en disolución no siempre es el mismo que el de sus correspondientes sales sólidas. Esto se debe a que los iones de manganeso forman complejos con el agua debido a la capacidad de aceptación de electrones de sus orbitales atómicos d. Además, la tendencia de las especies químicas a aceptar electrones varía con el pH y la temperatura, por lo que si cambias estas variables o las cantidades de los productos químicos, los colores variarán, y los cambios de color se producirán en diferentes momentos de los experimentos.
Nicola Graf
Configuración electrónica y metales de transición
Los electrones están dispuestos en niveles de energía que se denominan capas electrónicas. Cada capa se divide en subcapas, que están formadas por orbitales. Los metales de transición suelen tener uno o más electrones en su orbital d más externo. La diferencia de energía entre los electrones de orbitales d individuales es relativamente pequeña, por lo que los cationes de metales de transición tienen una variedad de formas de establecer enlaces químicos que implican diferentes números de electrones en orbitales d. Esta es la razón por la que los metales de transición tienen varios estados de oxidación.
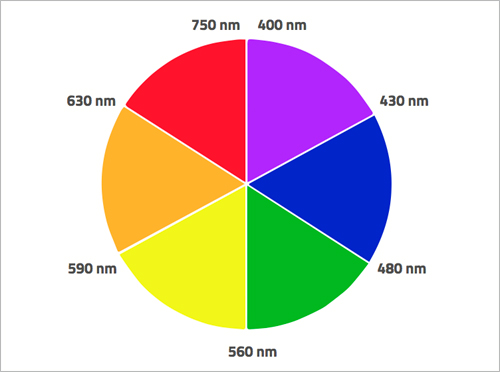
Cuando los electrones absorben ciertas frecuencias de radiación electromagnética, saltan a un nivel de energía más alto. En muchos metales de transición, la diferencia de energía entre los orbitales d corresponde a la energía de la radiación del espectro de luz visible. Por ejemplo, los electrones de orbitales d de los iones de permanganato absorben radiación electromagnética de la parte amarilla del espectro visible, pero lo que vemos como el color de una disolución con iones permanganato es el complementario, es decir, púrpura. Vemos el color de las longitudes de onda restantes que no fueron absorbidas (figura 4).
Nicola Graf
Discusión
Para relacionar esta demostración realizada con chupachups con la química de las reacciones redox, puedes preguntar a tus alumnos algunas de las siguientes cuestiones:
- ¿Cuál es el agente reductor que aporta electrones en las reacciones redox del experimento?
Depende del azúcar reductor que se utilice, pero en nuestro experimento, el agente reductor es la glucosa (C6H12O6). - ¿Cuál es el agente oxidante que acepta electrones?
El primer agente oxidante en la reacción lo constituyen los iones permanganato. Después, los electrones se transfieren a los iones manganato. - ¿La disolución de manganato de potasio absorbe la parte de la luz visible que corresponde al color que vemos (verde) o a su complementario (rojo)?
El manganato de potasio absorbe radiación electromagnética de la parte del rojo del espectro visible, pero lo que vemos como color de los iones manganato es el color complementario, verde. - ¿Conoces otros elementos químicos que muestren colores diferentes en distintos estados de oxidación en disolución?Entre otros ejemplos, están: cromo (Cr2O72–, naranja; CrO42–, amarillo) y vanadio (V2+, violeta; V3+, verde; VO2+, azul; VO43–, amarillo)
- Los compuestos de manganeso se utilizan en aceros inoxidables y baterías, como aditivos para combustibles y para pigmentos. El manganeso es también un cofactor esencial para muchas enzimas, como las que facilitan la fotosíntesis en los cloroplastos. Sin embargo, en grandes cantidades es tóxico para los humanos.
Variaciones del experimento
Este experimento se puede realizar de varias maneras diferentes. Por ejemplo, en lugar de usar un chupachup, se podría usar un chicle que contenga azúcar como agente reductor; o en lugar de agregar la glucosa en un matraz erlenmeyer, puedes añadirla a una botella de plástico y agitarla para observar los cambios de color (ver figura 5). Tus alumnos podrían desarrollar su creatividad para pensar en experimentos alternativos.

Marisa Prolongo
Agradecimientos
Este artículo está basado en una presentación realizada en el festival de Ciencia en Acción (sección española del programa Science on Stage) en 2014. El trabajo se llevó a cabo inicialmente por alumnos del I.E.S. Manuel Romero (Málaga). Agradecemos la ayuda prestada por la Universidad Politécnica de Madrid (proyectos “Promoción del aprendizaje experiencial de la química” y “Chem-Innova”) y por la Real Sociedad Española de Química (RSEQ).
Web References
- w1 – Para variaciones del experimento, visita las direcciones Science Brothers website y Hobby Chemistry website.
- w2 – Un vídeo del experimento está disponible en español en YouTube y en IES Manuel Romero Secondary School website.
Resources
- Para ideas sobre la introducción de reacciones redox usando ejemplos de la vida cotidiana, véase:
- Voak H (2016) Redox resources. Science in School 36.
- Para probar un experimento de cambio de color con pigmentos vegetales sensibles al pH, véase:
- Shimamoto GG, Vitorino Rossi A (2005) Una introducción artística a las tintas con antocianinas. Science in School 31.
Institutions
Science on StageReview
La química redox del manganeso es un aspecto fascinante de la química de los metales de transición. Este ejercicio práctico sencillo ayuda a los alumnos a familiarizarse con los variados estados de oxidación del manganeso y sus correspondientes colores.
Observar los diferentes colores favorecerá la discusión del proceso y será un punto de enfoque para comprender lo que está sucediendo en los pasos redox en la reacción.
Andrew Galea, profesor de química, Giovanni Curmi Higher Secondary School, Malta
