Renkli kimya: lolipoplarla redoks reaksiyonları Teach article
Bu basit ama göz alıcı aktivitede renk değiştiren redoks reaksiyonlarını aktive etmek için bir lolipop kullanın.
Oksidasyon-redüksiyon (redoks) reaksiyonlarının öğretilmesi, tüm ortaokul kimya müfredatının bir parçasıdır. Bu yazıda, elektronların farklı bileşikler ve iyonlar arasında aktarıldığı bir redoks reaksiyonları zincirini göstermek için renk değiştiren canlı bir gösteriyi tanıtıyoruz. Etkinlik bir öğretmen aktivitesi olarak uygundur veya daha büyük öğrenciler deneyi kendileri yapabilirler.

IanRedding/Shutterstock.com
Oksitleyici ve indirgeyici ajanlar
Bir redoks reaksiyonu, bir molekül, atom veya iyonun, oksidasyon durumunu değiştirerek elektronları kaybettiği veya kazandığı herhangi bir kimyasal reaksiyondur. Bir oksitleyici ajan elektronlar kazanır (ve reaksiyonda indirgenir) ve bir indirgeyici ajan elektronları kaybeder (ve reaksiyonda oksitlenir). Bu deneyde, indirgeme maddesi olarak lolipoptaki glukoz kullanılır. OH– iyonları içeren bir çözeltiye glukoz eklendiğinde, bunlardan biri glukozun aldehit gruplarındaki elektronları sağlayan çeşitli yarım reaksiyonlardan meydana gelir. Bu, karboksilat formunda (alkalin ortamına bağlı olarak) karboksilik gruplarına yol açar:
–CHO + 3 OH– → –COO– + 2 H2O + 2 e–
(aldehit grubu) (karboksilat olarak karboksilik grubu)
Ayrıca, glukozdaki alkol grupları da elektronları vererek karboksilik gruplarına (birincil alkoller söz konusu olduğunda) ve keton gruplarına (ikincil alkoller söz konusu olduğunda) neden olur:
–C(H)(OH)– + 2OH– → –C(=O)– + 2H2O + 2e–
(ikincil alkol) (keton grubu)
Deneyimizde, sodyum hidroksit (NaOH) ile birlikte bir permanganat çözeltisine glukoz ilave edildiğinden, glukozdan (C6H12O6) elektronlar ilk önce permanganat iyonlarına (MnO4–) verilir. İndirgeyici şekerin oksidasyon ürünleri esas olarak glukuronik asit (C6H10O7), artı biraz arabinonik asit (C5H10O6) ve formik asittir (CH2O2). Lolipop, glukoz yerine bu şekerin izomeri olan fruktozdan yapılırsa, ana ürün fruktonik asit olur (C6H10O7).
Bir dizi redoks reaksiyonunda, elektronlar sürekli olarak glukozdan ardışık mangan bileşiklerine verilir. Zincirdeki her adımda bir renk değişikliği görülebilir. Mangan bu deney için idealdir, çünkü her biri farklı bir renge sahip olan diğer geçiş metallerinden (+2’den +7’e) daha kararlı oksidasyon durumuna sahiptir.
Bu deneyin dayandığı klasik “kimyasal bukalemun” deneyine w1 aşina olmalısınız. Orijinal versiyonda, bir spatula ile karıştırıldığında renk değiştiren bir potasyum permanganat ve glukoz çözeltisi ile başlarsınız. Ancak, bunun yerine bir lolipop kullanırsanız, glukoz çözeltiye daha kademeli olarak eklenir, bu da renk değişikliklerini takip etmeyi kolaylaştırır. Minyatür bir elektrikli çırpma teli ile, lolipop elle karıştırmadan daha hızlı karıştırılır.
Materyaller
Aşağıdaki materyallere ihtiyacınız olacaktır (bkz. Şekil 1):
- Potasyum permanganat (KMnO4) kristalleri
- Glukoz içeren lolipop (veya fruktoz gibi diğer indirgeyici şeker)
- 3-4 adet sodyum hidroksit (NaOH) kristali (yaklaşık 0.5 g)
- 200 ml damıtılmış su
- 250 ml konik şişe veya beher (cam veya plastik)
- Kaşık ve spatula
- Minyatür elektrikli çırpma teli, ör. süt köpürtücü
- Yapışkan bant

Güvenlik notu
Laboratuar önlüğü, eldiven ve koruyucu gözlük kullanılmalıdır. Öğretmenler, özellikle potasyum permanganat kullanımı ve ortaya çıkan çözeltinin atılması ile ilgili olarak yerel sağlık ve güvenlik kurallarına uymalıdır. Ayrıca bkz. Genel güvenlik notu.
Yöntem
Etkinlik tek bir ders için uygundur. Deney sadece yaklaşık 15 dakika sürer ve bunu bir dizi tartışma sorusu izleyebilir.
Adımlar aşağıdaki gibidir:
- Şişeyi veya beher kabını 200 ml damıtılmış su ile doldurun.
- Tamamen eriyene kadar kaşıkla NaOH (3-5 adet) kristallerini karıştırın.
- Spatula kullanarak birkaç potasyum permanganat kristali ekleyin (çok fazla değil, aksi halde renk, değişiklikleri görülmeyecek kadar koyu olacaktır). Alkalin NaOH çözeltisine potasyum permanganat (KMn04) eklendiğinde, potasyum (K+) ve permanganat (Mn04–) iyonlarına dönüşür.
- Yapıştırma bant kullanarak, sarılmamış lolipopun çubuğunu mini elektrikli çırpıcıya bağlayın (bkz. Şekil 1).
- Lolipopu çözeltiye yerleştirin ve karıştırmaya başlamak için çırpma telini kullanın.
Lolipop çözeltiye çözündükçe, her redoks reaksiyonu için renk değişikliği gözlemleyeceksiniz. İlk iki değişiklik çok hızlı gerçekleşir (3-5 saniye), diğer değişiklikler biraz daha uzun sürer. Öğrenciler, renk değişikliklerini daha iyi karşılaştırmak ve takip etmek için çeşitli zaman aralıklarında fotoğraf çekebilir (örneğin bir cep telefonunun kamerasıyla). Yazarın deneyi gösteren bir videoyu İspanyolca w2 de bulabilirsiniz.
Deneyde neler olur?
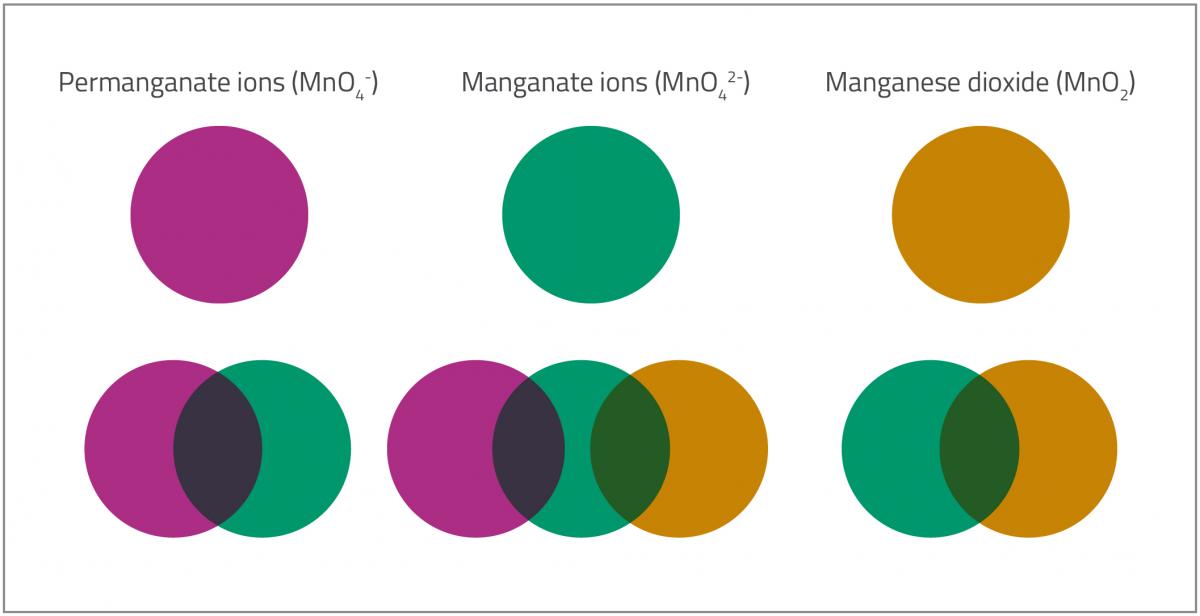
Lolipop mangan iyonları içeren çözelti içinde çözündükçe, manganın farklı oksidasyon durumlarına karşılık gelen en az beş farklı renk (Şekil 2’de gösterildiği gibi) ayırt edilebilir.
- İlk renk (mor) permanganat iyonlarına (MnO4–) karşılık gelir. Mangan +7 oksidasyon durumuna sahiptir.
- Permanganat iyonları (MnO4–) daha sonra manganat iyonlarına (MnO42-indirgenir. Mangan oksidasyon +7’den durumundan +6 durumuna değişir ve renk mordan yeşile değişir.MnO4–(aq) (mor) + e– → MnO42–(aq) (yeşil)Adım 1 ve 2 arasında bir ara mavi aşama meydana gelir. Bir açıklama, karışımın hem mavi permanganat (MnO4–hem de mavi bir çözelti üretmek için bir araya gelen yeşil manganat iyonlarını (MnO42-) içermesidir. Bir başka açıklama, permanganatın bir kısmının, oksidasyon durumu +5 ve mavi bir renge sahip olan hipomanganata (MnO43-) indirgenmiş olmasıdır.
MnO4–(aq) (mor) + 2e– → MnO43–(aq) (mavi)
- Oksidasyon durumu +6 olan manganat iyonları (MnO42-), +4 oksidasyon durumu ile mangan dioksite (MnO2) indirgenerek yeşilden sarı-kahverengiye bir renk değişikliğine neden olur.MnO42–(aq) (yeşil) + 2 H2O(l) + 2e– → MnO2(s) + 4OH–(aq) (sarı-kahverengi)
- Son olarak, çözeltiye daha fazla glukoz eklendiğinde, kahverengi-siyah mangan dioksit (MnO2) alkalin çözeltisi içinde (oldukça seyreltikse) turuncu görünebilen bir koloidal süspansiyon oluşturur.

Marisa Prolongo
Renk değişimleri
Lolipoplarda kullanılan gıda renklerinin bu deneyde gördüğünüz renkler üzerinde büyük bir etkisi yoktur, ancak diğer bazı faktörler rol oynamaktadır. Reaksiyonlar başladıktan sonra, her zaman çözeltide iyon karışımları vardır, bu da her zaman yorumlanması kolay olmayan renk karışımları ile sonuçlanır (bkz. Şekil 3).
Diğer bir faktör, çözeltideki mangan iyonlarının renginin genellikle karşılık gelen katı tuzlarının renginden farklı olmasıdır. Bunun nedeni, mangan iyonlarının atomik d-orbitallerinin elektron kabul etme kapasiteleri nedeniyle su ile kompleksler oluşturmasıdır. Ek olarak, moleküllerin elektron kabul etme eğilimi pH ve sıcaklığa göre değişir, bu nedenle bu değişkenleri veya kimyasalların miktarlarını değiştirirseniz, renkler değişir ve deneyler arasında farklı zamanlarda renk değişiklikleri meydana gelir.
Nicola Graf
Permanganate ions (MnO4–): Permanganat iyonları (MnO4–);
Manganate ions (MnO42-): Manganat iyonları ((MnO42-);
Manganese dioxide (MnO2): Mangan dioxide (MnO2)
Elektron konfigürasyonu ve geçiş metalleri
Elektronlar yörünge (kabuk) adı verilen enerji seviyelerinde düzenlenmiştir. Her kabuk, yörüngelerden oluşan alt kabuklara ayrılmıştır. Geçiş metalleri en dıştaki d-orbitalinde bir veya daha fazla elektrona sahiptir. Bireysel d-orbital elektronları arasındaki enerji farkı nispeten küçüktür, bu nedenle tüm geçiş metali katyonları, farklı sayıda d-orbital elektronu içeren kimyasal bağlar oluşturmak için çeşitli yollara sahiptir. Bu nedenle geçiş metallerinin birkaç oksidasyon durumu vardır.
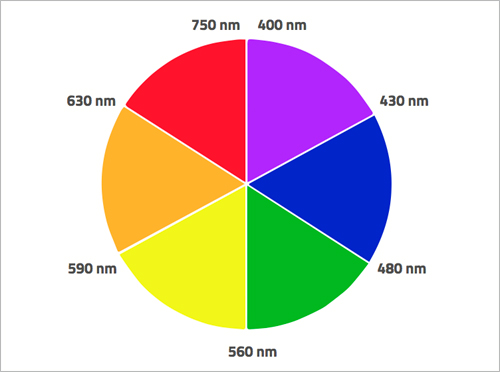
Elektronlar belirli elektromanyetik radyasyon frekanslarını emdiğinde, daha yüksek bir enerji seviyesine atlarlar. Birçok geçiş metalinde, d-orbitalleri arasındaki enerji farkı, görünür ışık spektrumunun radyasyon enerjisine karşılık gelir. Örneğin, permanganat iyonlarının d-orbital elektronları, görünür spektrumun sarı kısmından elektromanyetik radyasyonu emer, ancak permanganat iyonlarının rengi olarak gördüğümüz, sarıya tamamlayıcı renktir (yani mor). Gördüğümüz renk emilmeyen kalan dalga boylarının rengidir (şekil 4).
Nicola Graf
Tartışma
Lolipop deneyini redoks reaksiyonlarının kimyasıyla ilişkilendirmek için, öğrencilerinize aşağıdaki sorulardan bazılarını sorun:
- Deneyde redoks reaksiyonlarında elektron veren indirgeyici ajan nedir?
Bu durum, hangi indirgeyici şekeri kullandığınıza bağlıdır. Ancak deneyimizde indirgeyici ajan glukozdur (C6H12O6). - Elektronları kabul eden oksitleyici ajan nedir?
Reaksiyondaki ilk oksitleyici ajan permanganat iyonlarıdır. Daha sonra, elektronlar manganat iyonlarına verilir. - Çözeltideki potasyum manganat, görünür ışığın gördüğümüz renge (yeşil) veya tamamlayıcı rengine (kırmızı) karşılık gelen kısmını emer mi?
Potasyum manganat, görünür spektrumun kırmızı kısmından elektromanyetik radyasyonu emer, ancak manganat iyonlarının rengi olarak gördüğümüz tamamlayıcı renk yeşildir. - Çözeltide farklı oksidasyon durumlarında farklı renkler gösteren başka kimyasal elementler biliyor musunuz?
Örnekler şunları içerir: krom (Cr2O72–, turuncu; CrO42–, sarı) ve vanadyum (V2+, menekşe; V3+, yeşil; VO2+, mavi; VO43–, sarı) - Manganın biyoloji veya endüstride başlıca kullanım alanları nelerdir?
Mangan bileşikleri paslanmaz çeliklerde ve bataryalarda, yakıt katkı maddesi olarak ve pigmentlerde kullanılır. Mangan ayrıca kloroplastlardaki fotosistem II gibi birçok enzim için vazgeçilmez bir kofaktördür. Bununla birlikte, büyük miktarlarda vücuda alındığında insanlar için toksiktir.
Deneyin varyasyonları
Bu deney birkaç farklı yolla gerçekleştirilebilir. Örneğin, bir lolipop kullanmak yerine, indirgeyici ajan olarak şeker içeren bir sakız kullanabilirsiniz; veya bir cam behere glukoz eklemek yerine, plastik bir şişeye ekleyebilir ve renk değişikliklerini gözlemlemek için sallayabilirsiniz (bkz. şekil 5). Öğrencileriniz yaratıcılıklarını alternatif deneyleri düşünmek için kullanabilirler.

Marisa Prolongo
Teşekkür
Bu makale 2014 yılında İspanyol Bilim festivalinde (Ciencia en Acción) bir sunuma dayanmaktadır. Bu çalışma ilk olarak İspanya’nın Malaga kentindeki IES Manuel Romero Ortaokulu öğrencileri tarafından gerçekleştirilmiştir. Madrid Teknik Üniversitesi’nin (Universidad Politécnica de Madrid) ‘Kimyada deneysel öğrenmenin teşviki ve ‘Chem-Innova’ ve İspanyol Kraliyet Kimya Topluluğu (Real Sociedad Española de Química) projelerine destek için minnettarız, RSEQ).
Web References
- w1 – Deneyin varyasyonları için Science Brothers web sitesini ve Hobby Chemistry web sitesini ziyaret edin.
- w2 – Deneyin bir videosunu İspanyolca ve IES Manuel Romero Ortaokul web sitesinde İspanyolca olarak bulabilirsiniz.
Resources
- Günlük örnekleri kullanarak redoks reaksiyonlarını tanıtmaya yönelik fikirler için bkz:
- Voak H (2016) Redox resources. Science in School 36.
- To try a colour-change experiment involving pH-sensitive plant dyes, see:
- Shimamoto GG, Vitorino Rossi A (2005) An artistic introduction to anthocyanin inks. Science in School 31: 32–36.
Institutions
Science on StageReview
Manganın redoks kimyası, geçiş metali kimyasının büyüleyici bir örneğidir. Bu basit pratik egzersiz, öğrencilerin manganın değişken oksidasyon durumlarını ve ilgili renklerini tanımasına yardımcı olur.
Farklı renkleri gözlemlemek tartışmayı ortaya çıkaracak ve reaksiyondaki redoks adımlarında neler olduğunu anlamak için bir odak noktası olacaktır.
Andrew Galea, kimya okutmanı, Giovanni Curmi Ortaokulu, Malta
