Kolorowa chemia: reakcje redoks z lizakami Teach article
Wykorzystaj lizaki do aktywacji zmieniających kolor reakcji redoks w tym prostym, ale przyciągającym wzrok ćwiczeniu.
Nauczanie o reakcjach utleniania-redukcji (redoks) jest częścią programu nauczania chemii w szkołach średnich. W tym artykule opisujemy żywe, zmieniające kolor demonstracje, mające na celu przedstawienie łańcucha reakcji redoks, w czasie których elektrony przechodzą pomiędzy różnymi substatami i jonami. To zadanie jest dobre jako prezentacja przygotowana przez nauczyciela, natomiast uczniowie starszych klas mogą ten eksperyment przeprowadzić również sami.

IanRedding/Shutterstock.com
Czynniki utleniające i redukujące
Reakcja redoks to każada reakcja chemiczna, w której cząsteczka, atom lub jon traci bądź zyskuje elektrony, zmieniając tym samym swój stopień utlenienia. Substancja utleniająca zyskuje elektrony (ulegając tym samym redukcji), natomiast substancja redukująca traci elektrony (i zostaje w danej reakcji utleniona). W tym doświadczeniu glukoza z lizaka zostanie wykorzystana jako czynnik redukujący. W momencie dodania glukozy do roztworu zawierającego jony OH– , dochodzi do szeregu pół-reakcji. W jednej z nich biorąc udział grupy aldehydowe zawarte w glukozie i oddające elektrony.
Prowadzi to do powstawania grup karboksylowych w postaci karboksylanu (ze względu na środowisko alkaliczne):
–CHO + 3 OH– → –COO– + 2 H2O + 2 e–
(grupa aldehydowa) (grupa karboksylowa jako karboksylan)
Co więcej, grupy alkoholowe w glukozie również oddają elektrony, prowadząc do powstania grup karboksylowych (w przypadku alkoholi pierwszego stopnia) oraz grup ketonowych (w przypadku alkoholi drugiego stopnia):
–C(H)(OH)– + 2OH– → –C(=O)– + 2H2O + 2e–
(alkohol wtórny) (grupa ketonowa)
W naszym eksperymencie glukoza jest dodawana do roztworu nadmanganianu wraz z wodorotlekniem sodu (NaOH), przez co elektrony z glukozy (C6H12O6) są najpierw przekazywane jonom nadmanganianu (MnO4–). Utlenionymi produktami redukcji cukru są głównie kwas glukuronowy (C6H10O7), oraz pewne ilości kwasu arabinowego (C5H10O6) i kwasu mrówkowego (CH2O2). Jeśli lizak zrobiony jest z fruktozy, będącej izomerem glukozy, głównym produktem reacji jest kwas fruktonowy (również C6H10O7).
W serii reakcji redoks, glukoza stale przekazuje elektrony kolejnym związkom manganianu. Na każdym etapie łańcucha można zaobserwować zmianę kolorystyczną. Mangan jest idealny do tego eksperymentu, ponieważ posiada więcej stałych stanów utlenienia, niż jakikolwiek inny metal prześciowy (od +2 do +7), a każdy z nich objawia się innym kolorem.
Możesz być zaznajomiony z klasyczną demonstracją „chemicznego kameleona”w1, której adaptacją jest ten właśnie eksperyment. W oryginalnej wersji, zaczynasz od roztworu nadmanganianu potasu z glukozą, który zmienia kolor po wymieszaniu go łopatką. Używając lizaka, glukoza jest dodawana do środowiska reakcji stopniowo, co ułatwia obserwację zmian kolorystycznych. Zastosowanie miniaturowej elektrycznej trzepaczki powoduje, że lizak będzie szybciej mieszany, niż dłonią.
Materiały
Będziesz potrzebował następujących materiałów (patrz ryc. 1):
- Kryształy nadmanganian potasu (KMnO4)
- Kulisty lizak zawierający glukozę (lub inny cukier redukujący, np. fruktozę)
- ¾ kulki wodorotlenku sodu (NaOH) (ok 0,5 g)
- 200 ml wody destylowanej
- Kolba stożkowa lub zlewka o pojemności 250 ml (szklana lub plastikowa)
- Łyżka i szpatułka
- Miniaturowa elektryczna trzepaczka, np. ręczny spieniacz mleka
- Taśma samoprzylepna

Marisa Prolongo
Notka bezpieczeństwa:
Należy mieć na sobie fartuch laboratoryjny, rękawiczki i okulary ochronne. Nauczyciele powinni postępować zgodnie z lokalnymi zasadami zdrowia i bezpieczeństwa, w szczególności dotyczących stosowania nadmanganianu potasu oraz usuwania powstałego roztworu. Zobacz także ogólną notkę bezpieczeństwa.
Procedura
Zadanie jest odpowiednie na jedną jednostke lekcyjną. Sam eksperyment trwa około 15 minut i może być połączony z zestawem pytań dyskusyjnych.
Kroki postępowania są następujące:
- Wypełnij kolbę lub zlewkę 200 ml wody destylowanej.
- Przy pomocy łyżki mieszaj kulki NaOH tak długo, aż się zupełnie rozpuszczą
- Przy pomocy szpatułki dodaj kilka kryształów nadmanganianu potasu (jednak nie za dużo, bo wtedy kolor będzie zbyt ciemny by móc zaobserwować zmiany). Gdy nadmanganian potasu (KMnO4) zostaje dodany do alkalicznego roztworu NaOH, rozpuszcza się na jony potasu (K+) i jony nadmanganianowe (MnO4–).
- Przy pomocy taśmy klejącej przymocuj patyczek odpakowanego lizaka do miniaturowej elektrycznej trzepaczki (patrz ryc.1).
- Umieść lizak w roztworze i włącz trzepaczkę.
Gdy lizak rozpuści się w roztworze, będziesz mógł zaobserwować zmiany kolorystyczne dla każdej z reakcji redoks. Pierwsze dwie zmiany nastąpią bardzo szybko (3 – 5 sekund), natomiast kolejne pojawią się dopiero po pewnym czasie. Uczniowie mogą robić zdjęcia (np. aparatem lub telefonem komórkowym) na różnych etapach by następnie łatwiej porównać i zaobserować zmiany w kolorze. Wideo nakręcone przez autorów i ukazujące eksperyment jest dostępne w języku hiszpańskimw2.
Co się dzieje w czasie eksperymentu?
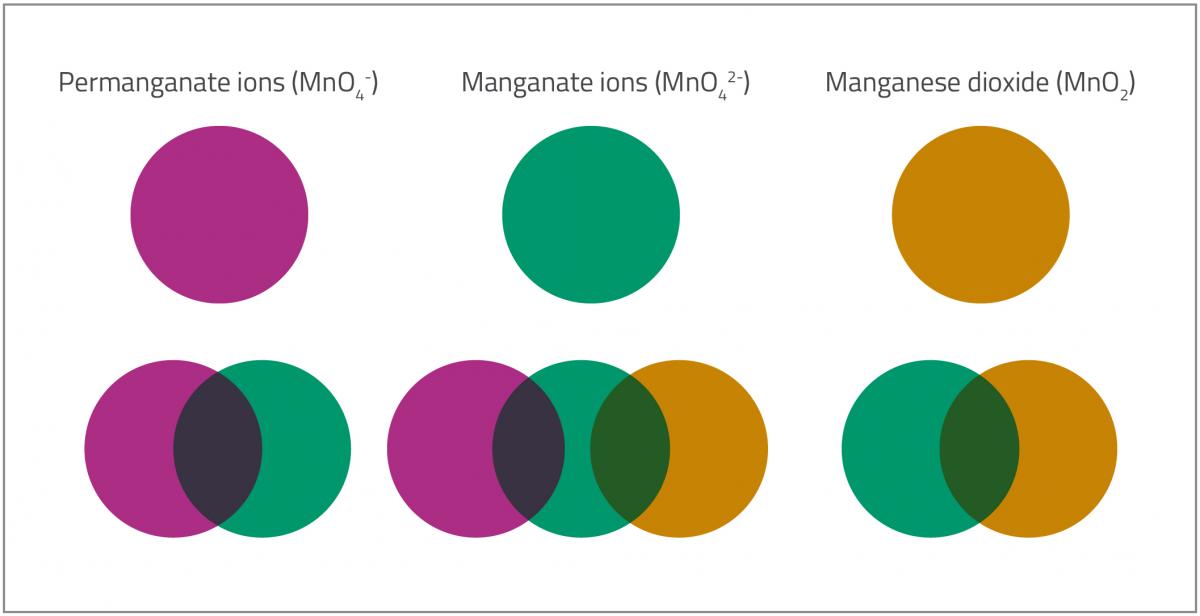
W czasie, gdy lizak rozpuszcza się w roztworze zawierającym jony manganianowe, można rozpoznać przynajmniej pięć różnych kolorów (jak pokazano na ryc. 2)., które korespondują z różnymi stopniami utlenienia manganu.
- Pierwszy kolor (fioletowy) to kolor jonów nadmanganianowych (MnO4–). Mangan jest na stopniu utlenienia +7.
- Jony nadmanganianiowe (MnO4–) ulegają następnie redukcji do jonów manganianowych (MnO42–). Stopień utlenienia manganu zmienia się z +7 na +6, a kolor przechodzi z fioletowego w zielony.MnO4–(aq) (fioletowy) + e– → MnO42–(aq) (zielony)Pośredni etap niebieski występuje pomiędzy pierwszym a drugim etapem. Jednym z wyjaśnień jest fakt, że mieszanina zawiera zarówno fioletowe jony nadmanganianowe (MnO4–) jak i zielone jony manganianowe (MnO42–), które zmieszane dają kolor niebieski. Innym wyjaśnieniem jest fakt, że część nadmanganianu ulega redukcji do podmanganianu, który posiada stopień utlenienia +5 i daje niebieski kolor.
MnO4–(aq) (fioletowy) + 2e– → MnO43–(aq) (niebieski)
- Jony manganinanowe (MnO42–), które mają stopień utlenienia +6 są następnie redukowane do dwutlenku manganu (MnO2), ze stopniem utlenienia +4, co wywołuje zmianę koloru z zielonego na żółto-brązowy.MnO42–(aq) (zielony) + 2 H2O(l) + 2e– → MnO2(s) + 4OH–(aq) (żółto-brązowy)
- Ostatecznie, gdy do roztworu zostanie doprowadzonych jeszcze więcej glukozy, brązowo-czarny dwutlenek manganu (MnO2) tworzy koloidalną zawiesinę w roztworze alkalicznym, która (odpowiednio rozcieńczona) może wydawać się pomarańczowa.

Marisa Prolongo
Zmiany w kolorze
Barwniki spożywcze wykorzystywane przy produkcji lizaków nie mają specjalnego wpływu na kolor, jaki możesz zaobserwować w czasie eksperymentu, jednak kilka innych czynników na znaczenie. W momencie rozpoczęcia reakcji, w roztworze zawsze znajduje się mieszanina jonów, dająca ostatecznie mieszaninę kolorów, które nie zawsze są łatwe do interpretacji (patrz ryc. 3).
Innym czynnikiem jest to, że kolor jonów manganu w roztworze zasadniczo różni się od koloru odpowiadających im soli stałych. Dzieje się tak dlatego, że jony manganu, ze względu na zdolność przyjmowania elektronów przez ich d-orbitale, formują z cząsteczkami wody kompleksy. Co więcej, tendencja cząsteczek do przyjmowania elektronów zmienia się wraz z pH i temperaturą, dlatego, jeśli zmodyfikujesz te zmienne, lub ilości chemikaliów, kolory ulegną zmianie, a zmiany kolorystyczne pojawią się w innych przedziałach czasowych między eksperymentami.
Nicola Graf
Permanganate ions (MnO4–): Jony nadmanganianowe (MnO4–); Manganate ions (MnO42-): Jony manganianowe (MnO42-); Manganese dioxide (MnO2): Dwutlenek manganu (MnO2)
Konfiguracje elektronowe i metale przejściowe
Elektrony są rozłożone w obrębie poziomów energetycznych, zwanych powłokami. Każda powłoka podzielona jest na podpowłoki, które składają się z orbitali. Metale przejściowe mają jeden lub więcej elektronów na swoim zewnętrznym d-orbitalu. Na poziomie energetycznym, różnica pomiędzy poszczególnymi elektronami d-orbitalu jest stosunkowo mała, dlatego też metale przejściowe mogą tworzyć równania chemiczne na różne sposoby, angażując w to różne ilości elektronów z d-orbitalu. Dlatego też metale przejściowe posiadają kilka stanów utlenienia.
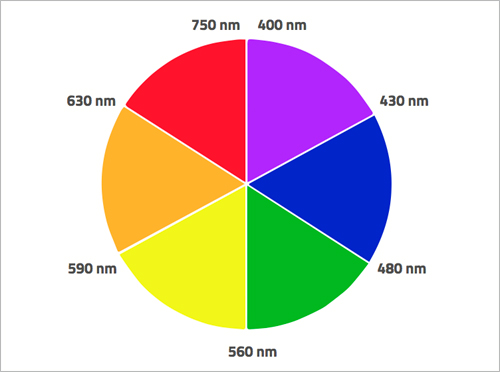
W momencie, gdy elektrony absorbują określone częstotliwości promieniowania elektromagnetycznego, przeskakują na wyższe poziomy energetyczne. W przypadku wielu metali przejściowych, różnica energetyczna między d-orbitalami odpowiada energii promieniowania widma światła widzialnego. Na przykład, elektrony d-orbitalu jonów nadmanganianowych absorbują promieniowanie elektromagnetyczne z żółtej części widma widzialnego, jednak to co widzimy jako kolor jonów nadmanganianowych, jest kolorem komplementarnym do żółtego – czyli fioletowym. Widzimy kolor pozostałych długości fali, które nie zostały zaabsorbowane (ryc. 4).
Nicola Graf
Dyskusja
Żeby połączyć demonstrację lizaka z chemicznymi reakcjali redoks, zadaj swoim uczniom niektóre z następujących pytań:
- Który substrat w tym eksperymencie pełni rolę czynnika redukującego, oddającym elektrony w reakcji redoks?
To zależy od tego, który cukier redukujący zastosowałeś, ale w naszym eksperymencie czynnikiem redukującym jest glukoza (C6H12O6). - Który substrat jest czynnikiem przyjmującym elektrony?
Pierwszym czynnikiem utleniającym w tej reakcji są jony nadmanganianowe. W późniejszym etapie elektrony są przekazywane jonom manganianowym. - Czy manganian potasu w roztworze absorbuje część światła widzialnego, która odpowiada barwie, którą widzimy (zielony), czy kolorowi komplementarnemu (czerwonemu)?
Manganian potasu absorbuje promieniowanie elektromagnetyczne z czerwonej części światła widzialnego, ale to, co widzimy jako kolor jonów manganianowych to kolor komplementary, zielony. - Czy znasz inne związki chemiczne, które barwią się na różne kolory w zależności od swojego stopnia utlenienia w roztworze?
Przykłady obejmują: chrom (Cr2O72–, pomarańczowy; CrO42–, żółty) i wanad (V2+, fioletowy; V3+, zielony; VO2+, niebieski; VO43–, żółty) - Jakie jest główne zastosowanie manganu, na przykład w biologii lub przemyśle?
Związki manganu są stosowane w stalach nierdzewnych i akumulatorach, oraz jako dodatki do paliwa i pigmenty. Mangan jest również niezbędnym kofaktorem dla wielu enzymów, takich jak fotosystem II w chloroplastach. Jednak w dużych ilościach jest szkodliwy dla ludzi.
Wariacje eksperymentu
Eksperyment można wykonać na wiele różnych sposobów. Na przykład, zamiast wykorzystywać lizak, mógłbyś użyć gumy do żucia zawierającej cukier jako czynnik redukujący; lub zamiast dodawać glukozę do probówki, mógłbyś ją umieścić w plastikowej butelce i potrząsać nią aby móc zaobserwować zmiany koloru (patrz ryc. 5). Twoi uczniowie mogliby wykorzystać swoją kreatywność do wymyślenia jeszcze innych alternatyw eksperymentu.

Marisa Prolongo
Podziękowanie
Artykuł oparty jest o prezentację z hiszpańskiej edycji festiwalu Science on Stage (Ciencia en Acción) z roku 2014. To doświadczenie zostało po raz pierwszy wykonane przez uczniów ze szkoły średniej IES im. Manuel Romero w Málaga, Hiszpania. Jesteśmy bardzo wdzięczni za wsparcie ze strony Uniwersytetu Technicznego w Madrycie (Universidad Politécnica de Madrid) przy projektach „Promocja eksperymentalnego uczenia się chemii” oraz „Chem-Innova” oraz Hiszpańskiego Królewskiego Towarzystwa Chemicznego (Real Sociedad Española de Química, RSEQ).
Web References
- w1 – więcej informacji na temat wariacji eksperymentu znajdziesz na stronie internetowej Science Brothers oraz stronie internetowej Hobby Chemistry.
- w2 – Wideo z eksperymentu jest dostępne po hiszpańsku na kanale YouTube oraz stronie internetowej szkoły średniej IES im. Manuel Romero.
Resources
- Pomysły na przedstawienie reakcji redoks z wykorzystaniem produktów codziennego użytku znajdziesz w:
- Voak H (2016) Redox resources. Science in School 36.
- Aby przeprowadzić eksperyment ze zmianą koloru z użyciem barwników roślinnych wrażliwych na pH, zobacz:
- Shimamoto GG, Vitorino Rossi A (2005) Artystyczne wprowadzenie do tuszów antocyjaninowych. Science in School 31.
Institutions
Science on StageReview
Chemia redukcyjna manganianu stanowi fascynujący aspekt chemii metali przejściowych. To proste ćwiczenie praktyczne pozwala uczniom na zapoznanie się z różnymi stanami utlenienia manganu oraz odpowiadającymi im kolorom.
Obserwowanie różnych kolorów wywoła dyskusję i będzie punktem wyjścia do zrozumienia co się dzieje na poszczególnych etapach reakcji redoks.
Andrew Galea, wykładowca chemii, Szkoła Średnia im. Giovanni Curmi, Malta
