Nel loro elemento: le donne della tavola periodica Understand article
Scoprite come delle scienziate hanno contribuito alla conoscenza degli elementi chimici – e quello che tutto ciò ci dice sulla natura del lavoro scientifico – di allora e di oggi.
Nel marzo 1869, il chimico russo Dmitri Mendeleev presentò il suo sistema periodico all’Accademia delle Scienze Russa (Gordin, 2004). Alla base di questo sistema c’era l’idea di Mendeleev di una legge periodica: una legge della natura che dimostrava la presenza di regolarità tra gli elementi. Il sistema di Mendeleev ha dimostrato di poter resistere ai nuovi sviluppi della scienza, dalla scoperta dei gas nobili e degli elementi radioattivi al mondo della fisica quantistica, e ora ha raggiunto il suo 150esimo anniversario.
Tuttavia, la storia della Tavola Periodica e dei suoi elementi ebbe inizio molto prima del 1869 – come pure la partecipazione delle donne a questa impresa collettiva. La storia di qualunque settore scientifico viene spesso raccontata dal punto di vista dei concetti e delle teorie principali, ignorando il lavoro sperimentale e le osservazioni inattese che hanno portato a questa comprensione teorica – ed è a questo aspetto relativamente trascurato al quale molte donne hanno dato i contributi più importanti. Come contrappunto a questa tendenza, in questo Anno Internazionale della Tavola Periodicaw1, guardiamo alle storie di alcune scienziate il cui lavoro ha contribuito in modo significativo alla nostra conoscenza degli elementi della tavola periodica.
18esimo secolo
Marie-Anne Lavoisier e il nuovo concetto di elemento chimico

Antoine Lavoisier (1788)
(cliccare per ingrandire)
Jacques-Louis David, pubblico
dominio
La riforma della chimica che ebbe luogo in Francia intorno al 1780 viene spesso celebrata come la nascita della chimica moderna. Centrale a questa riforma fu l’aristocratico francese Antoine Lavoisier. Nel suo Méthode de nomenclature chimique (1787), Lavoisier e i suoi collaboratori diedero dei nomi nuovi e sistematici a tutti gli elementi conosciuti, e crearono un insieme di regole per la denominazione dei composti, valide ancora oggi. Lavoisier introdusse anche il concetto di elemento chimico come sostanza semplice – una sostanza che non può essere decomposta durante l’analisi chimica – e presentò una tavola di 33 elementi. Sebbene non tutti siano ancora oggi considerati elementi, l’era dei quattro elementi – terra, aria, fuoco e acqua – era definitivamente conclusa.
In un famoso dipinto, Lavoisier è ritratto con sua moglie, Marie-Anne: lui sta lavorando, e lei posa come sua musa ispiratrice. Però, c’è molto altro nella loro storia. Marie-Anne partecipò al lavoro scientifico di Antoine assistendolo nell’attività di laboratorio e nella gestione della sua corrispondenza, ospitando nel suo salotto eruditi gentiluomini e signore provenienti dall’estero, e traducendo lavori accademici da altre lingue al francese e illustrando testi scientifici. Ebbe un ruolo anche nella diffusione della nuova chimica – in particolare dell’elemento ossigeno – traducendo e annotando criticamente un noto contributo alla teoria avversaria del ‘flogisto’ del chimico irlandese Richard Kirwan.
19esimo secolo
Jane Marcet porta gli elementi a conoscenza del pubblico
Nel 1806, alcuni decenni dopo la rivoluzione chimica, Jane Marcet, una donna svizzera che viveva a Londra, scrisse un testo di chimica che ebbe 16 edizioni in Gran Bretagna e almeno 23 in America, e fu tradotto in francese, tedesco e italiano (Dreifuss & Sigrist, 2012).
Scritto in forma di dialogo e rivolto alle donne, questo popolarissimo libro di testo ebbe un successo che trasformò la chimica in un nobile ed elegante argomento di interesse per il grande pubblico, donne e ragazze comprese. Il materiale della Marcet era piuttosto aggiornato: lei si basò sulla tavola periodica di Lavoisier, ma ma incluse anche i metalli alcalini e alcalino-terrosi recentemente scoperti (Na, K, Mg, Ca, Sr, Ba) isolati da Humpry Davy. Menzionò anche gli elementi recentemente scoperti o isolati da Jöns Jacob Berzelius e dai suoi allievi (Ce, Th, Se, Si, Zr, Li, La, Er, Tb, V) come pure quelli scoperti da William Hyde Wollaston (Rh, Pd), Smithson Tennant (Os, Ir) e Charles Hatchett (il columbio, in seguito denominato niobio, Nb). Facendo parte della società scientifica londinese, riuscì attraverso le sue conoscenze a fornire una lista di elementi considerevolmente più lunga di quella di Lavoisier. Ma anche stando così le cose, la Marcet dovette pubblicare anonimamente le prime edizioni del suo libro.
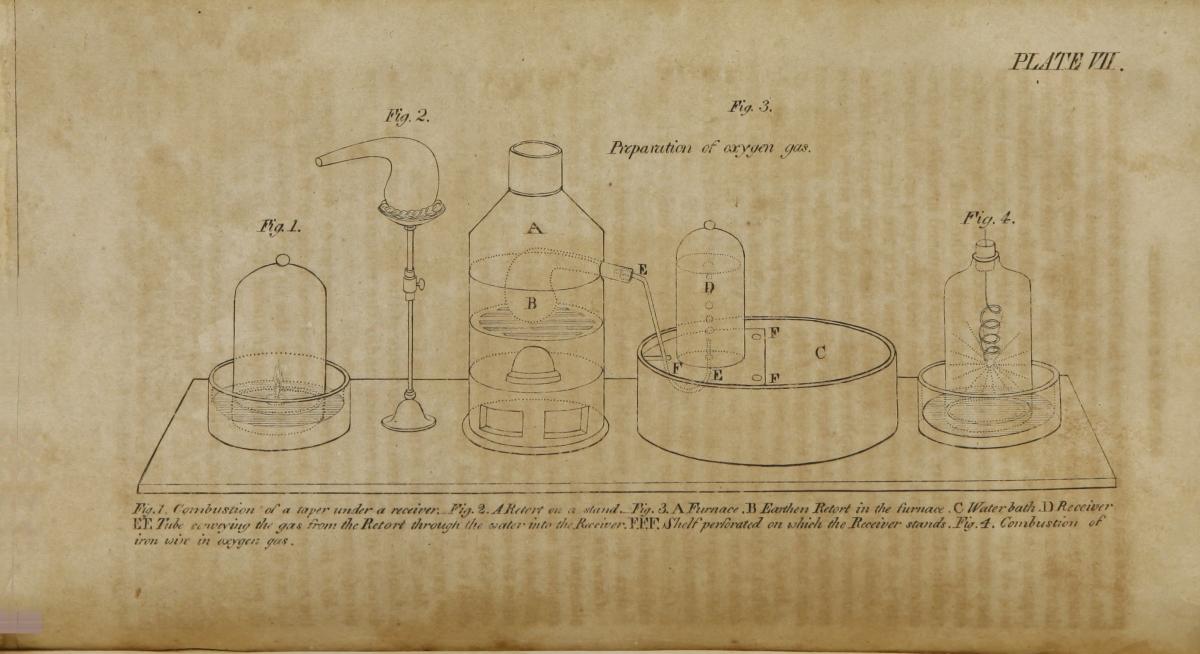
US National Library of Medicine/archive.org, pubblico dominio
Julia Lermontova e i platinoidi

A Karvain/Institut Mittag-
Leffler
Piuttosto diverso era lo status di Julia Lermontova, la prima donna in Germania (e una delle prime al mondo) ad essere insignita di un dottorato in chimica, nel 1874. Contemporanea di Dmitri Mendeleev, si formò ad Heidelberg sotto la guida di Robert Bunsen, lavorò con Wilhelm von Hoffman a Berlino, e conseguì il dottorato a Gottinga. La Lermontova portò avanti l’impegnativo lavoro sperimentale volto a trovare la giusta collocazione nel sistema periodico per gli elementi del gruppo del platino (Ru, Rh, Pd, Os, Ir, Pt). Questi elementi sono molto vicini l’uno all’altro per proprietà e pesi atomici, ma la necessità di avere pesi atomici precisi richiedeva che le sostanze venissero ottenute con la massima purezza. Questo compito richiedeva la ripetizione di precise metodiche analitiche, e un lavoro di questo tipo veniva spesso lasciato ai ‘soldati di fanteria’ come la Lermontova. I contributi di questo esercito ombra di chimici – molti dei quali donne – che erano richiesti per ottenere elementi puri o pesi atomici precisi vengono spesso dimenticati, ma sono una dimostrazione delle le autentiche sfide affrontate da Mendeleev e dai suoi contemporanei per organizzare tutti gli elementi conosciuti in un sistema significativo. Il lavoro non pubblicato della Lermontova rimase a lungo sconosciuto agli storici, ma fu poi riscoperto negli archivi di Mendeleev quasi 100 anni più tardi.
20esimo secolo
Marie Curie e gli elementi radioattivi

loro laboratorio, c. 1900
Wellcome Collection, CC BY 4.0
Benché il lavoro di Marie Curie sia ben conosciuto, riesce ancora a sorprendere: fin dalla scoperta del polonio e del radio fatta assieme al marito, Pierre Curie, e al loro collega Gustave Bémont nel 1898, Marie Curie e collaboratori dovettero trattare, con meticolose analisi chimiche, tonnellate del minerale pechblenda per arrivare ad ottenere 0.1 g di cloruro di radio nel 1902 (Quinn, 1995). In questo caso, la donna del gruppo, Marie, era sposata con uno scienziato, Pierre, ma essi portarono avanti progetti di ricerca indipendenti fino a quando Pierre non si rese conto del potenziale che c’era nel lavoro di Marie sulla radioattività, e si associò a lei nell’attività di laboratorio. In questo esempio, la figura dimenticata non è un’assistente donna, ma piuttosto il chimico maschio, Bémont.
Ida Noddack-Tacke e il renio

regola uno spettrometro a
raggi X in laboratorio, 1944
Universiteitsarchief Katholieke
Universiteit te Leuven
La chimica tedesca Ida Noddack-Tacke affrontò lo stesso sfinimento provato da Marie Curie quando isolò uno dei metalli più rari della Terra, il renio (Van Tiggelen, 2001). L’annuncio della scoperta del renio fu fatto nel 1925 da Ida Tackle e dal suo futuro marito, Walter Noddack (con l’aiuto di Otto Berg, un’altra figura maschile dimenticata), ma ci vollero altri tre anni affinché venissero ottenuti i primi 120 mg di renio puro, seguiti dalla prima misurazione del suo peso atomico nel 1929. Nel frattempo, la coppia di scienziati aveva individuato le località che secondo loro avrebbero fornito minerali ricchi in renio, aveva viaggiato in alcuni di questi luoghi, e trattato migliaia di campioni di minerali per isolare l’elemento. Pagine e pagine di appunti di laboratorio testimoniano il lavoro noioso e ripetitivo che non sempre dava i risultati sperati. Come i Curie, anche i Noddack erano una coppia collaborativa, anche se la carriera di Ida rimase , sia sul piano economico che accademico, nell’ombra di quella del marito.
Stefanie Horovitz e la prova dell’esistenza dei radioisotopi
Institute di Vienna, 1915
Austrian Central Library for
Physics, Vienna
Il lavoro della chimica Ebrea-Polacca Stefanie Horowitz ha fornito la prima prova autorevole del concetto di isotopi. Quest’idea – che lo stesso elemento potesse avere pesi atomici differenti – fu suggerita dal chimico britannico Frederick Soddy nel 1913 usando un termine coniato da una donna medico britannica, Margaret Todd. A quel tempo, erano stati scoperti circa 35 ‘elementi’ radioattivi – molti di più di quanti erano gli spazi vuoti lasciati per loro nel sistema periodico. Il concetto di isotopi avrebbe risolto questo crescente problema, dato che in seguito molti dei nuovi elementi radioattivi si sarebbero rivelati isotopi di elementi conosciuti. Tuttavia, il concetto in sé fu accolto inizialmente con un certo scetticismo.
Per supportare la teoria a favore degli isotopi, Soddy suggerì una base per l’indagine sperimentale: se il piombo poteva presentarsi sotto forma di diversi isotopi, allora il piombo che derivava dall’uranio avrebbe dovuto avere un peso atomico diverso da quello del piombo ordinario. Nel 1914, alla Horovitz furono assegnate queste ricerche dal suo supervisore, Otto Hönigschmid, al Radium Institute di Vienna. Passò quindi molti giorni a isolare campioni molto puri di piombo da minerali di uranio radioattivi, proseguendo poi con precise misurazioni gravimetriche per determinarne i pesi atomici. Il suo meticoloso lavoro fornì delle differenze nei pesi atomici che andavano al di là dell’errore sperimentale, confermando così l’esistenza degli isotopi.
Lavorando con Honigschmid, la Horovitz aiutò anche a confutare l’esistenza di quello che si supponeva fosse un nuovo elemento, lo ionio, dimostrando che aveva le stesse proprietà spettroscopiche e chimiche del torio, e che differiva dal torio ordinario solo per il peso atomico. Lo ionio venne quindi identificato come un isotopo del torio (Th-230).
Ellen Gleditsch e gli isotopi oltre i radioelementi

1927
Chris Koch
Sebbene fosse nata e avesse studiato in Norvegia, Ellen Gleditsch acquisì esperienza nella misura della radioattività inizialmente con un tirocinio nel laboratorio di Marie Curie a Parigi (Lykknes, 2005). Da lì, si trasferì all’Università di Yale, USA, dove con il suo lavoro stabilì un valore per la semivita del ‘radio’ (più tardi identificato come l’isotopo radio-226). Pubblicato nel 1915, questo valore fornì un’importante costante scientifica, in quanto il radio fu considerato come la sostanza standard in questo campo di ricerca.
Più tardi, all’Università di Harvard, USA, la Gleditsch (come la Horowitz) venne coinvolta nelle ricerche sugli isotopi. Era noto che il peso atomico degli elementi radioattivi (o di quelli che derivavano dal decadimento radioattivo) poteva variare in funzione della loro provenienza geologica. Per esempio, nei minerali naturalmente ricchi di torio, l’abbondanza di piombo-208 faceva innalzare il peso atomico del piombo, mente nei minerali ricchi di uranio (dove si produce piombo-206), il peso atomico del piombo veniva abbassato. Si pensava però che questa variabilità si verificasse solo per gli elementi associati alla radioattività, e non con gli elementi comuni più leggeri.
Ma nel 1919, l’invenzione da parte di Francis Aston dello spettrometro di massa, che permetteva separazioni molto accurate in funzione di massa atomica e carica, mise alla prova questo assunto. Quando Aston annunciò di aver trovato due masse atomiche distinte per il cloro (35 e 37) con una massa atomica media di 35.46, la sua affermazione fu accolta con scetticismo – come se anche in questo caso la composizione isotopica dovesse variare con la provenienza. L’intero concetto di massa atomica costante, sul quale era stato costruito il sistema periodico, sembrava essere in pericolo.
Quando la Gleditsch e i suoi collaboratori studiarono campioni di cloro di diversa provenienza, scoprirono che la composizione isotopica del cloro, in realtà, non variava in funzione dell’origine. Irène Curie (figlia di Pierre e Marie) a Parigi aveva ottenuto un risultato diverso, ma la Gleditsch arrivò alla conclusione che i campioni della Curie dovevano essere stati contaminati. Il peso atomico del cloro era quindi costante, dopo tutto, e la minaccia al concetto di pesi atomici stabili fu sconfitta.
Complessità e collaborazione
Nel corso della storia del sistema periodico, le donne hanno dato svariati contributi ai suoi fondamenti scientifici: nei salotti del 18esimo secolo; come traduttrici di lavori scientifici; come autrici di libri di testo e divulgatrici; come mogli, sorelle e figlie che collaboravano; come assistenti di ricerca, insegnanti e docenti universitarie; e in laboratori, scuole, case ed industrie (Watts, 2007). Le storie individuali di donne che hanno contribuito ad una nuova conoscenza degli elementi mostrano che il lavoro scientifico è complesso e sfaccettato, e che si basa sulla collaborazione. Così, queste storie non solo portano alla luce i contributi meno conosciuti che le donne (e alcuni uomini) hanno dato alla scienza: esse esprimono anche quella che è la vera natura della scienza e del lavoro scientifico.
Ringraziamenti
Gli autori dell’articolo desiderano ringraziare tutti gli altri autori che hanno scritto storie di donne ed elementi nel volume di imminente pubblicazione Women in their Element: Selected Women’s Contributions to the Periodic System (pubblicato da World Scientific, agosto 2019). Uno speciale ringraziamento va ai seguenti autori: Patrice Bret and Keiko Kawashima, Gisela Boeck, Peter Childs, John Hudson, Marelene e Geoffrey Rayner-Canham, e Xavier Roqué.
References
- Dreifuss JJ, Sigrist NT (2012) The making of a bestseller: Alexander and Jane Marcet’s Conversations on Chemistry. In Lykknes A, Opitz DL, Van Tiggelen B (eds) For Better or For Worse? Collaborative Couples in the Sciences pp 19–32. Basel, Switzerland: Birkhäuser/Springer. ISBN: 3034802854
- Gordin MD (2004) A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table. New York, USA: Basic Books. ISBN: 046502775X
- Lykknes A (2005) Ellen Gleditsch: Professor, Radiochemist, and Mentor. PhD thesis, Department of Chemistry, Norwegian University of Science and Technology, Trondheim, Norway.
- Quinn S (1995) Marie Curie: A Life. Cambridge, USA: Perseus Books. ISBN: 0201887940
- Van Tiggelen B (2001) The discovery of new elements and the boundary between physics and chemistry in the 1920s and 1930s. The case of elements 43 and 75. In Reinhardt C (ed) Chemical Sciences in the 20th Century: Bridging Boundaries pp 131–145. Weinheim, Germany: Wiley-VCH. ISBN: 3527302719
- Watts R (2007) Women in Science: A Social and Cultural History. London, UK: Routledge. ISBN: 0415253071
Web References
- w1 – Le Nazioni Unite hanno proclamato il 2019 l’Anno Internazionale della Tavola Periodica. Leggete l’annuncio sul sito web delle Nazioni Unite.
Resources
- Scoprite di più sull’Anno Internazionale della Tavola Periodica sul sito IYPT2019.
- Leggete di più su Jane Marcet e sul suo libro di testo in questo articolo di Chemistry World.
- Leggete le biografie di Marie Curie, Antoine Lavoisier e Jane Marcet sul sito web del Science History Institute.
- Ripercorrete la storia della tavola periodica leggendo di alcune altre modalità che sono state proposte per disporre gli elementi. Vedere:
- Lorch M (2019) Arranging the elements: the evolving design of the periodic table. Science in School 47: 26-29.
Review
Se a molti venisse chiesto di nominare delle donne che hanno contribuito allo sviluppo della tavola periodica, probabilmente farebbero fatica a citarne almeno una. Questo articolo è un rapido ma affascinante sguardo allo sviluppo di questa incredibile risorsa, ed mette in risalto molte donne dimenticate (e anche uomini) che fecero gran parte del lavoro ma ricevettero ben pochi riconoscimenti.
L’articolo potrebbe costituire un utile spunto di discussione o una lettura di base per un certo numero di argomenti in chimica. Possono essere fatti dei collegamenti interdisciplinari con altre aree scientifiche in cui i ruoli delle donne sono stati trascurati, come l’informatica, la matematica e l’esplorazione dello spazio. Sarebbe l’ideale per un’attività di lettura strutturata o come esercizio di comprensione. Possibili domande da porre sono:
- Descrivi il ruolo di Marie-Anne Lavoisier nello stabilire l’attuale concetto di elemento chimico.
- Spiega perché il libro di testo di Jane Marcet è riuscito con successo a portare gli elementi chimici a conoscenza del pubblico.
- Perché la determinazione dell’esatta collocazione di alcuni elementi è stato un compito così difficile?
Caryn Howard, capo dipartimento di chimica, St Mary’s School, Calne, UK
