Chimica classica: come si ricava la formula empirica Teach article
Osservate una spettacolare reazione chimica ed eseguite alcune misure accurate al fine di ricavare la formula empirica di un composto.
Ogni composto chimico ha una sua formula chimica. Infatti, vi sono diversi tipi di formule chimiche per ciascun composto (figura 1). Forse la formula più familiare è quella molecolare – del tipo H2O per l’acqua e CO2 per l’anidride carbonica – le quali ci dicono il numero di differenti atomi in ciascuna molecola. Le formule di struttura vanno un po’ oltre mostrando come gli atomi sono legati all’interno della molecola, che è particolarmente importante per i composti organici.
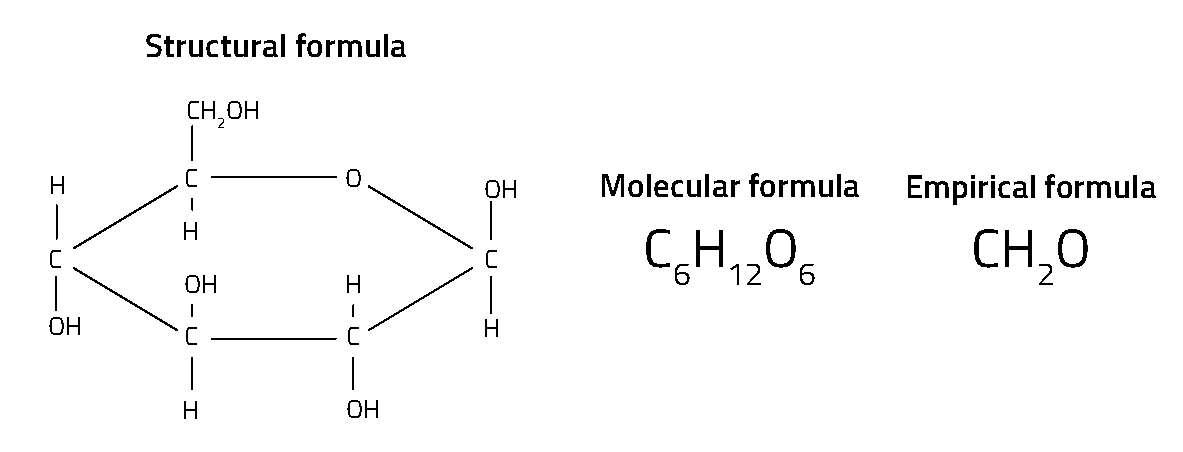
Il più semplice tipo di formula – chiamata la formula empirica – mostra il rapporto tra differenti atomi. Per esempio, mentre la formula molecolare del glucosio è C6H12O6, la sua formula empirica è CH2O – mostrando che vi è un numero doppio di Idrogeno o di Ossigeno rispetto agli atomi di Carbonio, ma non il numero reale di atomi di una singola molecola o come sono organizzate. Questa semplice formula, basata sul rapporto fu sviluppata dai primi chimici del 18.mo secolo. Sono conosciute come formule ‘empiriche’ poiché il rapporto tra il numero di atomi di un composto che si può ricavare mediante i metodi tradizionali dell’analisi chimica sperimentalmente.

Caroline Evans
Oggigiorno, ricavare sperimentalmente una formula empirica è un’importante caratteristica dei corsi di chimica in tutto il mondo. È anche il primo stadio nel ricavare una formula chimica di un composto ignoto, e diventa un utile strumento nell’analisi chimica. Nella scuola classica la dimostrazione comprende il riscaldamento del magnesio come cruciale per ricavare l’ossido di magnesio – una noiosa polverina bianca. In questo articolo, è riportata una alternativa molto più eccitante: una reazione drammatica tra lo stagno e lo iodio, che produce un vapore denso di colore viola e la produzione di cristalli arancio vivo che si formano mentre la reazione procede.
Lo scopo dell’esperimento è quello di calcolare il rapporto tra gli atomi di stagno e gli atomi di iodio nello ioduro di stagno. Questo si realizza sintetizzando il composto e misurandone accuratamente la massa dei reagenti all’inizio dell’esperimento e dello stagno rimanente alla fine. L’esperimento comprende un certo numero di tecniche, incluso l’utilizzazione di un condensatore a riflusso e l’utilizzo di un solvente organico per l’estrazione. È compreso inoltre un esercizio pratico di derivazione della formula empirica, l’esperimento è collegato a numerose altre caratteristiche della chimica teorica, come il vantaggio di utilizzare un reagente in eccesso, la sintesi dei composti dai loro elementi, e di come il legame si collega alla solubilità. Questa è altresì una reale e chiara applicazione della legge di conservazione della massa, che rappresenta il principio base fondamentale di tutta la chimica (e delle scienze in generale).
In funzione del numero di cappe chimiche disponibili nella classe, gli studenti potrebbero realizzare i loro esperimenti personalmente, ma è anche adatta alla dimostrazione da parte del docente. Per realizzare l’esperimento si impiegano circa due ore ed è meglio suddividere la lezione in due parti, è anche possibile dividere l’esperimento in due lezioni singole. Questo esperimento è adatto per studenti di età tra 16 – 18 anni, ma può essere utilizzato anche come una attività collaterale per quelli di età tra 14 –16 anni.
Materiali
L’insegnante (o ogni gruppo di studenti) avrà bisogno di:
- 3 g di iodio
- 5 g di stagno metallico, in piccoli pezzi non più grandi di 1 cm quadrato
- 60 ml di cyclohexane
- Propanone
- Fiasca tonda da 250 ml (per esempio come Quickfit®)
- Un cilindro graduato da 100 ml
- Due beaker de 250 ml
- Morsetti
- Piastra elettrica riscaldabile
- Condensatore di reflusso
- Riserva d’acqua
- Due grossi pezzi di filtri in carta
- Bilancia di precisione
- Lab jack (opzionale)
Nota di Sicurezza
Gli studenti devono indossare un grembiule da laboratorio, guati e occhiali di sicurezza. Lo iodio solido è corrosivo e può macchiare la pelle, ecco il perché bisogna indossare i guanti. L’esperimento deve essere eseguito sotto una cappa per i fumi. Poiché i vapori di iodio sono tossici, assicurarsi che nel caso di riscaldamento, il vapore color viola non risalga più di un terzo del percorso sino al condensatore di reflusso. Il Cicloesano e il propanone sono molto infiammabili, quindi è necessario avere un mantello anti riscaldamento, e deve essere posta molta cura nel tenere a distanza da fiamme libere questi due composti. Il propanone dovrebbe essere conservato in una bottiglia con residui di solvente. Altresì, l’insegnante deve seguire i regolamenti locali per la sicurezza e la salute.
Procedura
- Sistemare la fiasca a fondo rotondo sulla bilancia. Introdurre circa 3 g di iodio solido nella fiasca, e prendere nota accuratamente della massa aggiunta.
- Aggiungere circa 5 g di stagno metallico all’interno della fiasca e misurare accuratamente la massa dello stagno utilizzato.
- Morsettare la fiasca per il collo e aggiungere 60 ml di cicloesano.

Pesare lo iodio (passo 1)
Caroline Evans
Stagno e iodio nella fiasca (passo 2)
Caroline Evans
Fiasca con il cyclohexane aggiunto allo stagno e allo iodio (passo 3)
Caroline Evans - Abbassare la fiasca sulla piastra elettrica. Potreste utilizzare un contatto elettrico per alzare o abbassare il riscaldatore quando necessario.
- Collegare un condensatore a riflusso verticalmente sul collo della fiasca, quindi utilizzare la pinza e connetterlo alla fonte d’acqua.
- Scaldare con fuoco dolce la mistura contenuta all’interno della fiasca fino all’ebollizione.
- Ridurre a questo punto il calore così che la mistura possa bollire in maniera stabile e fino a quando i vapori viola risalgono ad una altezza di non più di un terzo del condensatore.
- Continuare a riscaldare fino a quando scompare ogni traccia dei vapori viola, e il liquido ritorna all’interno della fiasca, dal condensatore senza alcun colore. Il liquido nella fiasca dovrebbe essere arancione. Questo processo potrebbe durare sino ad un ora prima di completarsi.
- Permettere alla mistura della fiasca di raffreddarsi.

Sistemazione della fiasca, condensatore a riflusso e piastra riscaldante
Caroline Evans
Vapori di iodio che salgono appena si rscalda la mistura (passo 7)
Caroline Evans
Formazione del liquido arancione (passo 8)
Caroline Evans - In una cappa per i fumi, versare il liquido arancione all’interno della fiasca in un beaker, facendo attenzione a non trascurare nessun residuo di stagno metallico.
- Versare una piccola quantità di propanone nella fiasca ed agitare delicatamete per dissolvere eventuale ioduro di stagno residuo nell’eccesso di stagno solido. Con molta attenzione fare decantare il propanone trasferendolo in un altro beaker. Ripetere questo processo di scambiare i beaker fintanto il propanone versato dalla fiasca nei beaker diventa incolore. Questo passo assicura che lo stagno solido in fogli non contiene nessun residuo di stagno iodato di colore arancione.
- Lasciare il beaker con il liquido arancione (passo 10) sotto la cappa per i fumi per tutta la notte cosí che il solvente possa evaporare, in modo che si formino i bellissimi cristalli arancione di iodiuro di stagno (Potete osservare questo processo nella lezione seguente.)
- Trasferire il materiale che non ha reagito nella fiasca alla fine dell’esperimento in due grandi pezzi di filtri di carta. Lasciare che il filtro e lo stagno si asciughino all’aria, quindi pesare e registrare la massa risultante dallo stagno.
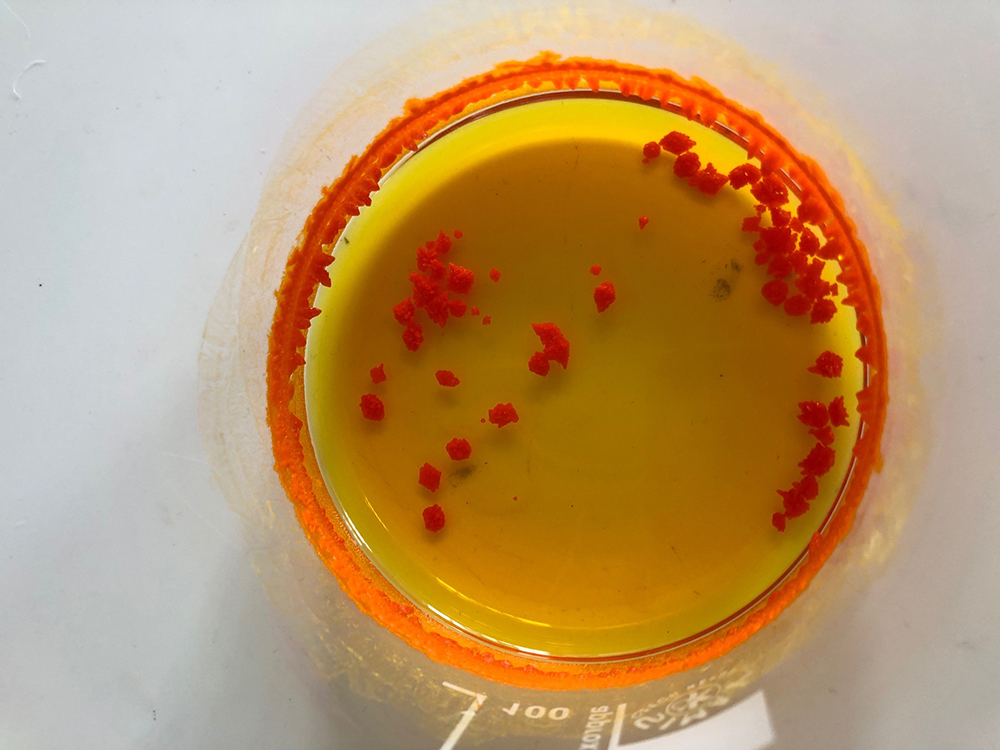
Formazione di cristalli di ioduro di stagno (passo 12)
Caroline Evans
Stagno residuo, asciugato sulla carta filtrante (passo 13)
Caroline Evans
Determinazione della formula empirica
Questi esperimenti si basano sulla reazione di due sostanze – lo stagno e lo iodio – nella loro forma elementare, al fine di produrre il composto di ioduro di stagno. Lo stagno possiede più di un possibile stato di ossidazione, così la reazione può produrre sia ioduro di stagno (II) (Sn I2) o ioduro di stagno (IV) (Sn I4). Utilizzando i dati sperimentali, possiamo ricavare la formula empirica per il prodotto, che ci fornirà il rapporto tra stagno e iodio. Da ciò possiamo ricavare l’identità del composto di stagno prodotto.
- Il primo passo è quello di ricavare le masse dello iodio e dello stagno nella reazione. Lo iodio è utilizzato totalmente per la reazione (dato che è il reagente limitante, mentre lo stagno è in eccesso), così possiamo utilizzare l’accurata pesatura della massa effettuata nel passo 1.
- Per calcolare la massa dello stagno utilizzato nella reazione, abbiamo bisogno di sottrarre la massa dello stagno rimasto una volta che la reazione è terminata, a partire dalla massa iniziale.
Lo stagno utilizzato nella reazione = massa iniziale (passo 2) meno la massa di quello rimasto (passo 13)
- Adesso abbiamo bisogno convertire le masse in mole, per ricavare la quantità di atomi di stagno e di iodio utilizzati nella reazione. Per fare questo, dividiamo il valore di ciascuna massa (dai passi 14 e 15) mediante la massa atomica relativa (Ar) dell’elemento. La risposta risultante ci dirà il numero di moli di ciascun elemento utilizzato (e così del composto finale).
- Per ricavare la formula empirica dello ioduro di stagno, abbiamo bisogno di trovare il numero di moli dello iodio utilizzato per ciascuna mole di stagno. Qui, dividiamo entrambe le risposte ricavate nel passo 16 per il numero di di moli di stagno utilizzate (così ci dirà quanti moli di iodio si combinano con una mole di stagno). Avrete bisogno di arrotondare leggermente il rapporto: per esempio, un rapporto di stagno su iodio di 1:3.6 può essere arrotondato a 1:4.
- Infine, potrete scrivere la formula empirica: per esempio, un rapporto di 1:4 significa che la formula empirica è SnI4. Qual è la formula empirica che avete trovato?
Discussione
Questa attività può produrre dei buoni risultati se portata avanti attentamente, con valori che dovrebbero essere molto vicini al valore arrotondato a 1:4 (come il rapporto di stagno e iodio). Questo dovrebbe produrre SnI4 come formula empirica per lo ioduro di stagno.
In generale i valori che spesso si ottengono possono spaziare da 1:3.2 a 1:3.8. Gli stati di ossidazione comuni per lo stagno sono +2 e +4, un risultato sperimentale dato come rapporto vicino a 1:3 non sarebbe plausibile. Tuttavia, tali valori possono aprire una discussione sulle cause degli errori sperimentali e l’importanza della precisione.
Fonti di errori sperimentali nelle misure
Dopo aver effettuato gli esperimenti, chiedete agli studenti di pensare a tutte le fonti di errore. Quali effetti potrebbero avere i seguenti sul risultato finale?
- Precisione della bilancia utilizzata
- Reazione incompleta dello iodio
- Perdita di vapori di iodio dal condensatore
- Lavaggio inaccurato del residuo di stagno
- Perdita di stagno mentre si risciaqua il propanone
- Essiccazione incompleta dello stagno prima di registrarne la massa.
La Tabella 1 riassume gli effetti di ciascuno di queste fonti di errore nell’esperimento e nel risultato finale – cioè, quanto ciascuno varia il valore di x nella formula empirica SnIx.
| Errore | Effetto su: massa dello stagno rimasto | Effetti sulla: massa dello stagno che ha reagito (massa iniziale meno i residui della massa) | Effetto su: valore di x (nel SnIx) |
|---|---|---|---|
| Reazione incompleta dello iodio | Aumenta perché non tutto lo stagno reagisce | Diminuisce | Aumenta |
| Perdita dello stagno residuo mentre si sciacqua il propanone | Decreases | Aumenta | Diminuisce |
| Essiccazione incompleta dei residui di stagno | Aumenta, sommando l’extra massa dal solvente | Diminuisce | Aumenta |
| Lavaggio insoddisfacente dei residui di stagno | Aumenta, come se una partedi ioduro di stagno fosse inclusa nei residui della massa | Diminuisce | Aumenta |
| Perdita dei vapori di di iodio dal condensatore | Aumenta, come se non tutto lo stagno fosse in grado di reagire | Diminuisce | Aumenta |
Estensione della discussione: solubilità e legame
Questo esperimento offre anche l’opportunità di discutere di quanto il legame sia legato alla solubilità. Lo iodio e lo ioduro di stagno si dissolvono in solventi non polari (cicloesano e propanone) ma non in acqua, mentre lo stagno è un metallo ed è insolubile nel cicloesano, propanone e acqua. Utilizzando questa informazione, i vostri studenti potranno trarre delle conclusioni sul comportamento del legame in queste sostanze?
Ringraziamenti
L’autrice è grata ad Alan Carter, il Direttore di Chimica al Wellington College (Berkshire, UK) fino al 2004, e che ha creato le risorse che hanno ispirato questo articolo.
Resources
- Informazioni sugli stati di ossidazione dello stagno si trovano in Chemguide website.
- Scoprite un esperimento alternativo di deduzione della formula empirica, questa volta con l’ossido di rame (II), al sito di Royal Society of Chemistry.
Review
Questo articolo descrive uno esperimento spettacolare per ricavare la formula empirica di un composto prodotto dai suoi elementi. Questo esercizio pratico fornisce agli studenti l’opportunità di andare oltre l’esercizio numerico quando si procede con le formule chimiche.
L’esperimento è adatto agli studenti in chimica senior che studiano la chimica analitica. Comprende un grande insieme di tecniche di sperimentazione e può essere utilizzato come punto di partenza per discussione su differenti sorgenti di errori sperimentali. Fornisce anche una base per altri argomenti chiave, incluso di come legame e solubilità siano collegati.
Tutto il materiale richiesto può essere facilmente recuperato e le istruzioni si possono seguire facilmente, rendendo le attività adatte agli studenti che lavorano in gruppo.
Mireia Güell Serra, insegnante di chimica e matematica, a INS Cassà de la Selva School, Spagna.
