Mettere in ordine gli elementi: l’evoluzione dell’aspetto della tavola periodica Inspire article
La tavola periodica è appesa alla parete di quasi tutte le classi in cui si studia chimica. Però, il suo aspetto, ormai iconico, avrebbe potuto essere molto diverso.

di John Dalton, con i simboli
da lui ideati (cliccare
sull’immagine per ingrandire)
Wellcome Collection, CC BY 4.0
Il merito per l’ideazione della tavola periodica in genere viene attribuito al chimico Dmitri Mendeleev. Nel 1869, egli riportò gli elementi allora noti (a quel tempo erano 63) su delle carte e li sistemò in colonne e righe in funzione delle loro proprietà chimiche e fisiche.
Ma la tavola periodica in realtà non ebbe origine con Mendeleev. In molti si erano cimentati nel mettere in ordine gli elementi. Decenni prima, il chimico John Dalton aveva provato a realizzare una tavola come pure dei simboli per gli elementi piuttosto interessanti (figura 1), ma questi non ebbero seguito. E solo alcuni anni prima che Mendeleev si sedesse con il suo mazzo di carte fatto in casa, John Newlands aveva ideato una tavola che ordinava gli elementi in funzione delle loro proprietà.
Tuttavia, la genialità di Mendeleev sta in quello che lasciò fuori dalla tavola. Egli si rese conto del fatto che mancavano alcuni elementi, non ancora scoperti. Così dove Dalton, Newlands e altri avevano sistemato ciò che era noto, Mendeleev lasciò spazio per l’ignoto. Ancora più sorprendentemente, egli predisse accuratamente le proprietà degli elementi mancanti.

elementi di Dmitri
Mendeleev, che mostra gli
spazi (allora) vuoti per gli
elementi mancanti (cliccare
sull’immagine per ingrandire)
Wikimedia Commons, di
pubblico dominio
Vedete i punti di domanda nella tavola della figura 2? Per esempio, vicino all’alluminio (Al), c’è uno spazio per un metallo sconosciuto. Mendeleev predisse che questo avrebbe avuto una massa atomica di 68, una densità di 6 g/cm3 e un bassissimo punto di fusione. Sei anni più tardi, Paul Émile Lecoq de Boisbaudran isolò il gallio che, come previsto, si collocava perfettamente nello spazio lasciato libero, con una massa atomica pari a 69.7, densità 5.9 g/cm3 e un punto di fusione così basso che lo si può liquefare semplicemente tenendolo in mano. Mendeleev fece la stessa cosa con lo scandio, il germanio e il tecnezio (che non fu scoperto che nel 1937, 30 anni dopo la sua morte).
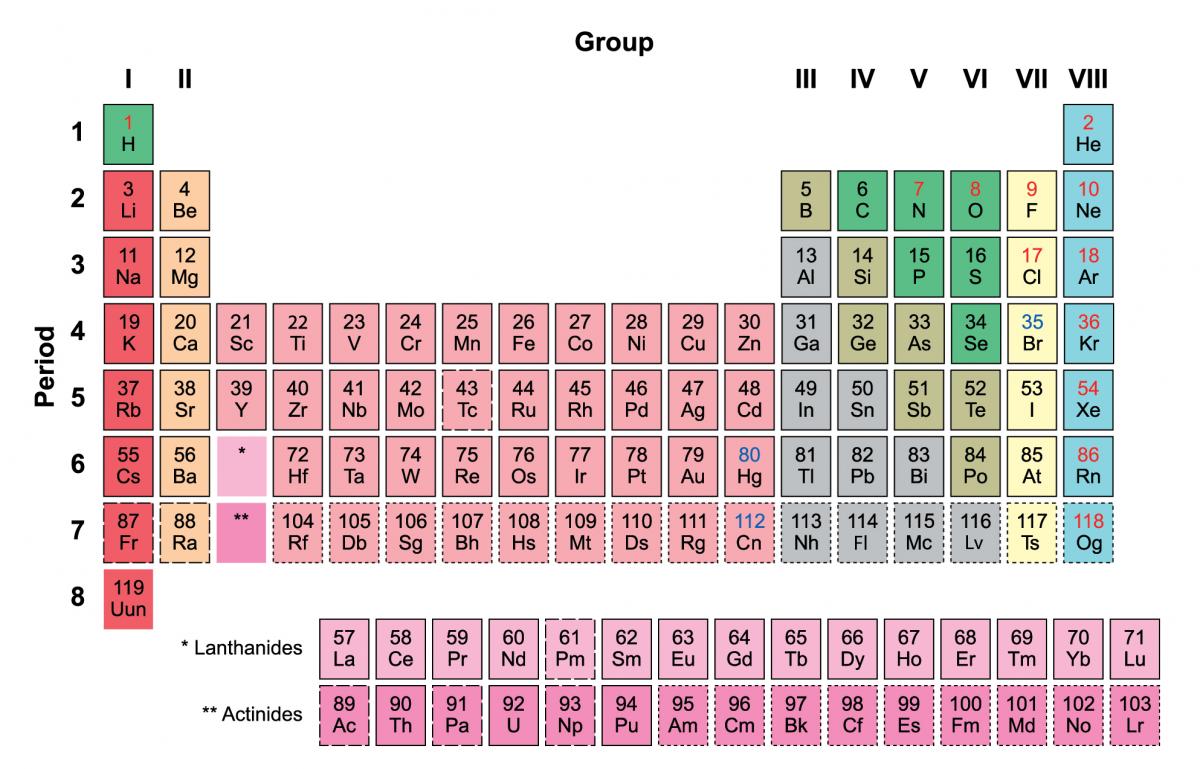
A prima vista, la tavola di Mendeleev non assomiglia molto a quella alla quale siamo abituati. Per prima cosa, la tavola moderna contiene vari elementi che Mendeleev non aveva considerato (e per i quali non aveva previsto una collocazione), in primo luogo i gas nobili (come l’elio, il neon e l’argon). Inoltre, la tavola è orientata diversamente rispetto alla nostra versione moderna, con elementi che noi ora mettiamo insieme secondo delle colonne, piuttosto che in righe.
Ma una volta che la tavola di Mendeleev viene girata di 90°, la somiglianza con la versione moderna diventa evidente (figura 3). Per esempio, gli alogeni – fluoro (F), cloro (Cl), bromo (Br) e iodio (I) (il simbolo J nella tavola di Mendeleev nella figura 2) – appaiono tutti vicini uno all’altro. Oggi essi sono tutti disposti in ordine nella diciassettesima colonna della tavola.
Armtuk/Wikimedia Commons, CC BY-SA 3.0
Periodo di sperimentazione

spirale degli elementi di
Heinrich Baumhauer, con
l’idrogeno al centro.
Ristampata su autorizzazione
di Quam & Quam (1934)
(cliccare sull’immagine per
ingrandire)
Copyright Division della
Chemical Education, Inc.
dell’American Chemical Society
Il salto da questo diagramma a quello che ci è familiare potrebbe sembrare piccolo ma, anni dopo le pubblicazioni di Mendeleev, furono fatte molte prove con disposizioni alternative degli elementi. Persino prima che la tavola venisse permanentemente ruotata di un angolo retto, furono suggerite alcune torsioni bizzarre e sorprendenti.
Un esempio che colpisce in modo particolare è la spirale di Heinrich Baumhauer (figura 4), pubblicata nel 1870, con l’idrogeno al centro e gli elementi con massa atomica crescente che vanno verso l’esterno seguendo una spirale. Gli elementi che si trovano su ciascuno dei raggi della ruota mostrano delle proprietà comuni – proprio come fanno quelli di un gruppo nella tavola odierna. C’è stata anche l’alquanto bizzarra impostazione ‘a manubrio’ di Henry Basset del 1892.
Tuttavia, dall’inizio del ventesimo secolo, la tavola ha assunto stabilmente il formato orizzontale che ci è ben noto, con la versione dall’aspetto moderno di Alfred Werner del 1905. Per la prima volta, i gas nobili sono apparsi nella loro posizione, che ora ci è familiare, all’estrema destra della tavola. Werner provò anche a prendere esempio da Mendeleev lasciando degli spazi vuoti, anche se esagerò un po’ con le congetture, ipotizzando che ci fossero elementi più leggeri dell’idrogeno e un altro elemento che si collocava tra l’idrogeno e l’elio – nessuno dei quali esiste.
Malgrado i progressi di Werner, c’erano ancora delle sistemazioni da fare. Particolarmente influente fu la versione di Charles Janet del 1929 (figura 5). Egli ebbe un approccio ‘da fisico’ alla tavola ed utilizzò la teoria quantistica da poco scoperta per creare una disposizione basata sulle configurazioni elettroniche. La tavola risultante, detta ‘left step’, è ancora oggi preferita da molti fisici. È interessante il fatto che Janet abbia anche lasciato spazio per ulteriori elementi fino al numero 120, malgrado il fatto che a quei tempi ne fossero noti solo 92 (e oggi siamo solo a 118).
Wikipedia, CC BY-SA
Stabilire un design

Mendeleev’, una versione 3D
della tavola periodica
(cliccare sull’immagine per
ingrandire)
Тимохова Ольга/Wikimedia
Commons, CC BY-SA 3.0
La tavola moderna è in realtà una evoluzione diretta della versione di Janet. I metalli alcalini (il gruppo capitanato dal litio) e i metalli alcalino-terrosi (con in testa il berillio) furono spostati dall’estrema destra all’estrema sinistra per creare una tavola periodica molto ampia (forma estesa). Il problema di questo formato è che non si adatta bene alle pagine o ai poster, così, in gran parte per ragioni estetiche, gli elementi del blocco f di solito vengono separati e collocati al disotto della tavola principale. Ecco come si è arrivati alla tavola che oggi conosciamo.
Questo non significa che non si sia continuato ad armeggiare con il suo design, spesso come tentativo di evidenziare correlazioni tra gli elementi che non sono così evidenti nelle tavole convenzionali. Ci sono letteralmente centinaia di varantiw1, con spirali e versioni 3D (figura 6) che sono molto popolari, per non parlare di versioni più giocose.
Cosa ne pensate della mia fusione di due grafici: la tavola di Mendeleev e la mappa della metropolitana di Londra di Henry Beck (figura 7)? O la vertiginosa schiera di ‘simil-tavole periodiche’ che classificano di tutto, dalla birra ai personaggi Disney – che dimostrano tutte come la tavola periodica degli elementi sia diventata un simbolo iconico della scienza.
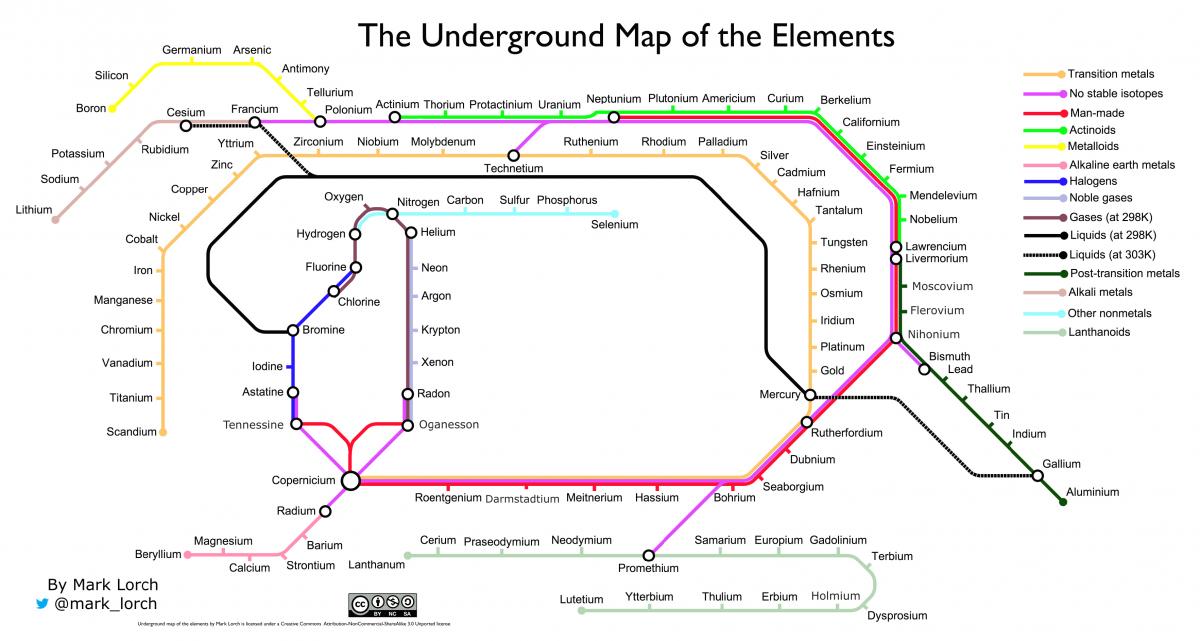
Mark Lorch, CC BY NC-SA 3.0
Ringraziamenti
Questa è una versione modificata dell’articolo originariamente pubblicato su The Conversation UK. Leggete l’articolo originale sul sito web di The Conversation UKw2.![]()
References
- Quam GN, Quam MB (1934) Types of graphic classifications of the elements. III. Spiral, helical, and miscellaneous charts. Journal of Chemical Education 11: 288-297. doi: 10.1021/ed011p288
Web References
- w1 – Esplorate centinaia di versioni della tavola periodica sul database di Mark Leach.
- w2 – The Conversation è una fonte indipendente di notizie e opinioni scritte da accademici e ricercatori ad uso del pubblico. Per vedere la versione originale di questo articolo, visitate il sito web di The Conversation UK.
Resources
- Ascoltate la canzone di Tom Lehrer sulla tavola periodica ‘The Elements’.
- Guardate un video del ‘cuore pulsante’ del gallio della serie Periodic Table of Videos dell’Università di Nottingham.
- Scoprite di più su alcuni degli scienziati meno celebri, molti di questi sono donne, che hanno contribuito allo sviluppo della tavola periodica. Vedere:
- Lykknes A, Van Tiggelen B (2019) Nel loro elemento: le donne della tavola periodica. Science in School 47.
