Une chimie colorée : les réactions redox des sucettes. Teach article
Le sucre des sucettes convient bien pour illustrer visiblement les réactions redox du manganèse.
On enseigne les réactions redox dans tous les cours de chimie de niveau secondaire. Cet article présente les différents changements de couleur qui accompagnent une cascade de réactions redox, où des electrons sont échangés entre différents composés et/ou ions. Cette activité peut facilement être exécutée en classe par le maître. Elle peut aussi être exécutée par des élèves expérimentés.

Agents réducteurs et oxydants.
Une réaction redox est une réaction dans laquelle un atome perd ou gagne des électrons, donc change son degré d’oxydation. Un oxydant gagne des électrons (et se réduit dans l’opération). Un réducteur perd des électrons (et s’oxyde dans la réaction). Dans l’expérience présente, le glucose d’une sucette sert de réducteur. Quand le glucose est ajouté à une solution basique, le groupe aldéhyde du glucose donne des électrons et se transforme en un groupe acide. Cet acide se présente sous forme de groupe carboxylate, à cause de la presence du milieu basique :
–CHO + 3 OH– → –COO– + 2 H2O + 2 e–
(groupe aldéhyde) (groupe carboxylique, ici carboxylate)
De plus, les groupes alcool du glucose donnent aussi des électrons, en formant des groupes carboxyliques (avec les alcools primaires) et des groupes cétone (avec les alcools secondaires)
–C(H)(OH)– + 2OH– → –C(=O)– + 2H2O + 2e–
(alcool secondaire) (groupe cétone)
Dans notre expérience, on ajoute du glucose à une solution de permanganate et d’hydroxyde de sodium NaOH : les électrons du glucose (C6H12O6) sont captés par les ions permanganate (MnO4–). Le glucose se trouve alors oxydé en acide glucuronique (C6H10O7) et partiellement en acide arabinonique (C5H10O6) et en acide formique (CH2O2). Si la sucette est faite de fructose, qui est un isomère du glucose, il se forme de l’acide fructonique (aussi C6H10O7).
Les électrons cédés par le glucose produisent une série de réactions en cascade qui forment différents composés de manganèse, et qui ont tous des couleurs différentes. Le manganèse est l’élément idéal pour cette expérience, car il possède plus d’états d’oxydation que n’importe quel autre métal (de +2 à +7), et chaque fois avec une autre couleur.
Vous connaissez probablement la démonstrationw1classique dite “caméléon minéral”. L’expérience actuelle en est une adaptation. Dans la version originale, on ajoute du glucose à une solution de permanganate, et la couleur change par agitation avec une spatule. Quand on utilise une sucette, le glucose est ajouté plus graduellement, et c’est plus facile de suivre les changements de couleur. D’autre part, l’emploi d’un fouet de cuisine accélère la dissolution du sucre.
Matériel
On va utiliser le materiel suivant (voir en Figure 1) :
- Des cristaux de permanganate de potassium (KMnO4)
- Une sucette sphérique contenant un sucre réducteur (glucose ou fructose)
- 3 à 4 grains d’hydroxyde de sodium NaOH (environ 0.5 g)
- 200 mL eau distillée
- un bécher ou un Erlenmeyer de 250 mL (en verre ou en plastique)
- Cuillère et spatule
- Un petit fouet de cuisine, pour faire mousser le lait
- Bande de papier adhésif

Marisa Prolongo
Notes de sécurité
Le port d’une blouse de travail, de lunettes de sécurité et de gants est requis. Les maîtres doivent suivre les consignes de sécurité locales, en particulier celles concernant l’emploi de permanganate et l’élimination des déchets. Voir aussi la notice générale de sécurité.
Mode opératoire
Cette activité s’effectue en une seule leçon. L’expérience dure 15 minutes et peut être suivie de toute une série de questions.
Les différentes étapes sont les suivantes.
- Remplir le bécher ou l’erlenmeyer de 200 mL eau distillée.
- Ajouter les grains de NaOH en agitant constamment avec la cuillère jusqu’à leur dissolution complète.
- Ajouter à la spatule quelques cristaux de permanganate de potassium (pas trop, sinon la solution sera noire plus tard). Après cette adjonction, la solution de NaOH contient des ions potassium K+ et permanganate MnO4–.
- Fixer le bâton de la sucette, sans son emballage de papier, à l’axe du fouet de cuisine à l’aide de bande adhésive (Voir figure 1).
- Introduire la sucette dans la solution et enclancher le moteur pour voir l’effet sur le mélange.
A mesure que la sucette se dissout dans la solution, sa couleur va changer, à chaque réaction redox. Les deux premiers changements se passent très vite (3 à 5 secondes). Les changements suivants sont plus lents. Les élèves peuvent prendre des photos avec la caméra de leur téléphone à différents moments, pour comparer ensuite les changements de couleur. Une vidéo prise par les auteurs en espagnol est disponiblew2.
Explication chimique de l’expérience
Lorsque la sucette se dissout dans la solution de permanganate, on observe cinq différentes couleurs (voir figure 2), qui chacune correspond à un état d’oxydation différent du manganèse.
- La première couleur violette est due à l’ion permanganate (MnO4–). Le manganèse est au degré d’oxydation +7.
- Les ions permanganate MnO4– sont alors réduits en ions manganate (MnO42-). Le degré d’oxydation du manganèse passe de +7 à +6, et la couleur passe de violet à vert.MnO4–(aq) (violet) + e– → MnO42–(aq) (vert)On observe une étape intermédiaire bleue entre les étapes 1 et 2. Une explication est que la solution contenant les deux ions permanganate (MnO4–) violets et manganate (MnO42-) verts prend la couleur bleue par un effet d’optique. Une autre explication serait que le permanganate serait d’abord réduit en hypomanganate (MnO43–) qui est bleu et au degré d’oxydation +5
MnO4–(aq) (violet) + 2e– → MnO43–(aq) (bleu)
- Les ions manganate verts (MnO42–), où Mn est au degré d’oxydation +6, sont réduits en dioxyde de manganèse (MnO2), où Mn est au degré d’oxydation +4, ce qui cause un changement de couleur du vert au brun.MnO42–(aq) (vert) + 2 H2O(l) + 2e– → MnO2(s) + 4OH–(aq) (brun))
- Enfin, quand toujours plus de glucose est incorporé à la solution, il se fome une suspension colloïdale brune de dioxyde de manganèse (MnO2) qui prend parfois une teinte orangée (à haute dilution)

Marisa Prolongo
Variations de couleur
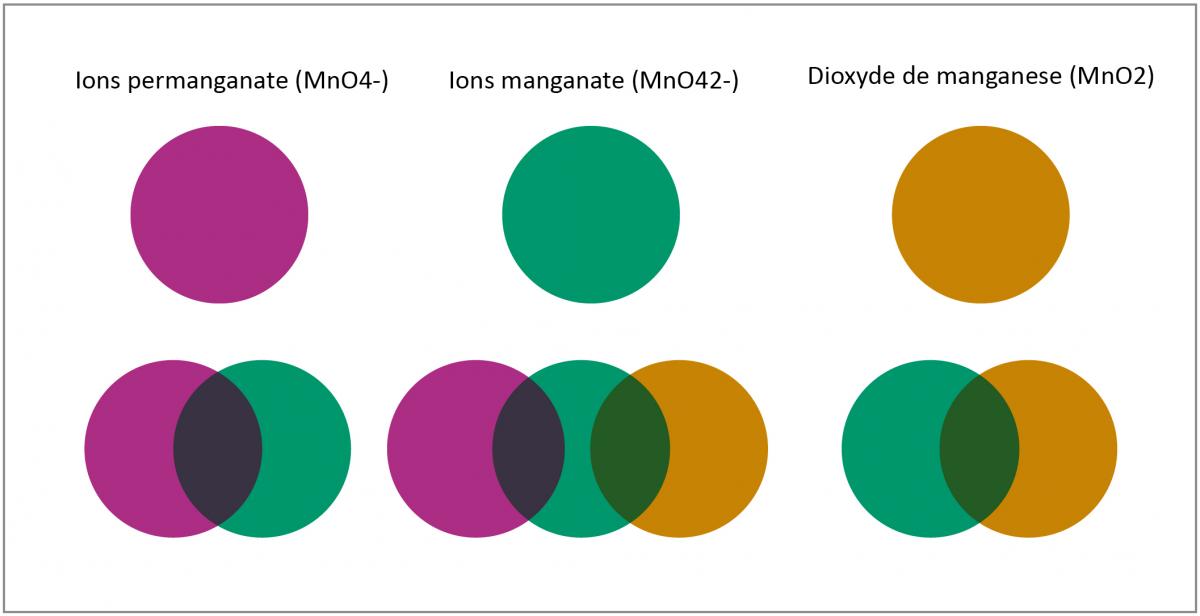
Le colorant artificial incorporé à la sucette n’a pas d’effet sur la couleur de la solution. Mais d’autres facteurs interviennent. Il arrive que, une fois la réaction lancée, le mélange des ions initiaux et finaux produise des couleurs qui ne sont pas toujours faciles à interpréter (Voir la figure 3).
Un autre facteur est que la couleur des ions du manganèse en solution diffère de celle des sels solides. Et cette différence est due au fait que les orbitales d du manganèse ont la capacité d’accepter les électrons des ligands, donc de former des complexes avec l’eau. De plus cette faculté d’accepter des électrons dépend du pH et de la température. Donc, si on change le pH, la température et les quantités de réactifs, ces couleurs vont varier, et les changements de coloration vont se produire au bout d’espaces de temps qui peuvent varier beaucoup.s
Nicola Graf
Configuration électronique des métaux de transition
Les électrons sont arrangés sur des niveaux d’énergie dits couches. Chaque couche est divisée en sous-couches, qui sont constituées d’orbitales. Les métaux de transition ont au moins un électron dans leur orbitale externe d. Et comme la différence d’énergie entre les sous-couches d est petite, les cations de ces métaux peuvent former un nombre variable de liaisons avec ces électrons d. Cest pourquoi les métaux de transition ont plusieurs degrés d’oxydation.
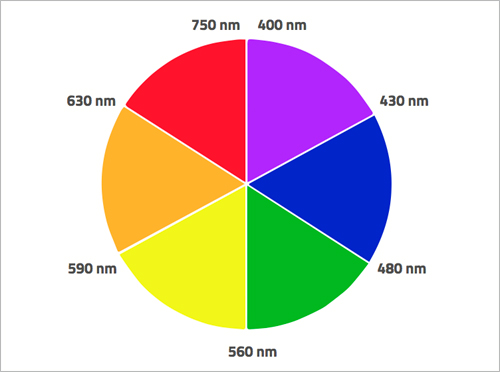
Quand un électron absorbe une radiation électromagnétique d’une certaine fréquence, il passe sur un niveau d’énergie supérieur. Dans de nombreux métaux de transition, la différence d’énergie entre les sous-niveaux d correspnd à l’énergie de la lumière visible. Par exemple, les électrons d du permanganate absorbent un rayonnement dont l’énergie correspond à la partie jaune du spectre visible. Donc nous voyons la couleur complémentaire du jaune, le violet. En effet, la couleur que nous voyons d’un objet est toujours la partie du spectre qui n’est pas absorbée par l’objet (figure 4).
Nicola Graf
Discussion
Si vous voulez vous assurer que vos élèves ont compris cette démonstration, posez leur les questions suivantes :
- Dans cette expérience quel est le réducteur qui fournit les électrons des réactions redox ?Ceci dépend bien sûr du sucre utilisé. Dans notre expérience, il s’agissait de glucose (C6H12O6).
- Quel est l’agent oxydant qui accepte les électrons ?Le premier agent oxydant est l’ion permanganate. Ensuite, c’est l’ion manganate.
- Est-ce que le manganate en solution absorbe la partie de la lumière visible qui correspond à la couleur qu’on voit de lui (vert) ou à sa couleur complémentaire (rouge)L’ion manganate absorbe la radiation électromagnétique provenant de la partie rouge du spectre visible. Ce que nous voyons de lui est la couleur complémentaire, le vert.
- Connaissez-vous d’autres éléments qui changent de couleur selon le degré d’oxydation ?On peut citer les exemples du chrome (Cr2O72–, orange; CrO42–, jaune) et du vanadium (V2+, violet; V3+, vert; VO2+, bleu; VO43–, jaune).
- Quels sont les usages principaux du manganèse, en biologie et dans l’industrie ?Le manganèse est utilisé dans les aciers inox, dans les piles, dans les pigments et comme additifs des carburants. En biologie il se trouve dans le cofacteur de certaines enzymes, comme le photosystème II des chloroplastes. En quantités importantes, il est toxique.
Variations de l’expérience
Cette expérience peut être effectuée de différentes façons. Par exemple, on peut remplacer la sucette par du chewing gum, s’il contient un sucre réducteur ; ou bien, au lieu d’ajouter du glucose dans un récipient ouvert, on peut l’ajouter dans une bouteille de plastique qu’on agite pour observer la couleur (voir figure 5). Et vos élèves auront peut-être des idées pour réaliser d’autres expériences.

Marisa Prolongo
Remerciements
Cet article est basé sur une présentation faite en 2014 au festival espagnol de Science on Stage (Ciencia in Accion). Ce travail a d’abord été monté par les élèves de l’école secondaire Manuel Romero de Malaga, Espagne. Nous saluons l’appui que l’Université Technique de Madrid (Universidad Politécnica de Madrid) a apporté aux projets “Promotion de l’enseignement expérimental de la chimie” et “Chem-Innova”. Remercions aussi la Société Royale de Chimie (Real Sociedad Española de Química, RSEQ).
Web References
- w1 – On trouve des variations de cette expérience sur Science Brothers website et Hobby Chemistry website.
- w2 – Une vidéo en espagnol de cette expérience se trouve sur YouTube et sur IES Manuel Romero Secondary School website.
Resources
- On trouvera des idées pour introduire les réactions redox dans la vie quotidienne à
- Voak H (2016) Redox resources. Science in School 36.
- Et voici une expérience de changements de couleur avec des colorants végétaux sensibles au pH :
- Shimamoto GG, Vitorino Rossi A (2005) Une introduction artistique aux encres à base d’anthocyanes. Science in School 31.
Institutions
Science on StageReview
La chimie redox du manganèse présente un aspect fascinant de la chimie des métaux de transition. Cet exercice simple et pratique familiarise les élèves avec les nombreux états d’oxydation du manganèse et leurs couleurs respectives.
L’observation des différentes couleurs suscite la discussion et constitue un bon point de départ pour comprendre ce qui se passe dans une réaction redox.
Andrew Galea, maître de chimie, Ecole secondaire supérieure Giovanni Curmi, Malte
