Supporting materials
Helium Additional Material Spanish
Download
Download this article as a PDF

Helio: un gas increíble, maravilloso y preocupante. ¿Llegó la hora de darle el respeto que merece a este gas noble?

Helio: un gas tan inspirador. El segundo elemento más común en el universo, material de las estrellas, es de menor densidad que el aire. Por eso, cuando sueltas un globo lleno de helio este se eleva por los aires. Tomar una bocanada de helio puede hacer que suenes como el pato Donald, la razón se encuentra en los pliegues vocales y la velocidad del sonido en helio. Sin embargo, no intentes esto en casa porque uno de los peligros potenciales en la lista de evaluación de riesgos del helio es la muerte.[1]
¿Qué sabemos del helio? ¿De dónde lo obtenemos? ¿Para qué lo usamos? ¿Cuál será nuestra relación en el futuro con este fascinante gas no reactivo?
La palabra helio proviene de Helios, dios griego del sol, porque este elemento se descubrió en el sol antes de que se conociera en la Tierra. El espectro de la corona solar, es decir, la corona de gas caliente que rodea a la superficie incandescente del sol, se analizó durante un eclipse solar en 1868.

Los diferentes elementos absorben diferentes colores de luz y nos dan un ‘código de barras’ para identificar los elementos presentes
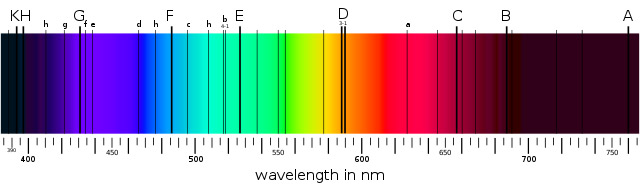
Además de los códigos de barras para los elementos conocidos como el hidrógeno y el sodio, el francés Jules Janssen encontró un grupo de líneas que no encajaban con ningún elemento conocido. Norman Lockyer de Inglaterra, sugirió que el sol contenía un elemento desconocido en la Tierra y lo llamó helio.
En 1881, se descubrió el mismo patrón en el gas del monte Vesubio en Italia. Eventualmente, se pudo recolectar helio: un gas de densidad muy baja no reactivo, que se uniría al argón, al xenón y al kriptón. En 1902 Mendeléiev agregó una columna nueva a su tabla periódica para estos ‘gases nobles’.
El helio es el segundo elemento más abundante en el universo. Se formó durante el Big Bang y existe en grandes cantidades en las estrellas, que liberan energía al fusionar átomos de hidrógeno para producir helio. Sin embargo, el helio de la Tierra se produce gracias al decaimiento alfa que ocurre dentro de la corteza terrestre. Los elementos radioactivos como los isotopos de uranio, emiten partículas alfa, que son núcleos de helio. Estas partículas alfa de carga positiva doble atraen a un par de electrones y ahí lo tienes, un átomo de helio.
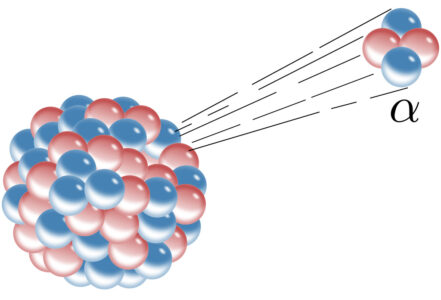
Los pequeñísimos átomos de helio se cuelan a través de los espacios entre las partículas de rocas permeables, por lo que el helio se ha escapado de la Tierra a lo largo de millones de años. Existen solamente unos cuantos depósitos de gas helio, son poco comunes y se forman cuando el helio queda atrapado dentro de bóvedas en la roca impermeable.
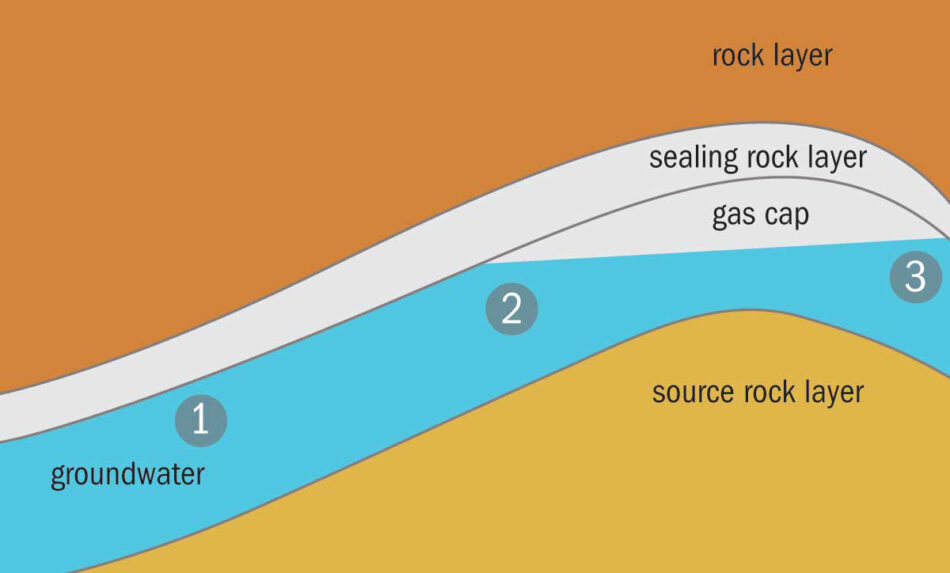
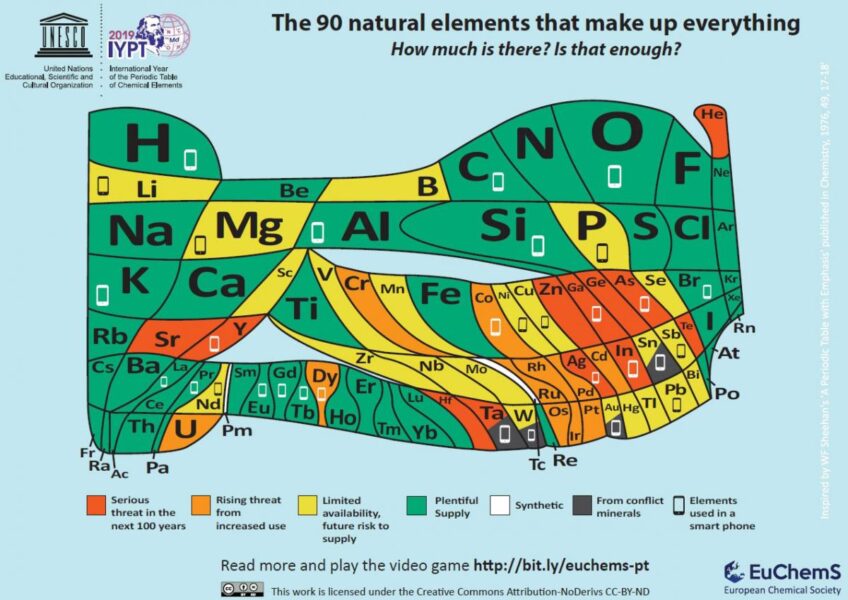
Se pueden encontrar ejemplos en Qatar, EE. UU., Rusia y Argelia. Algunas de estas reservas se están agotando y debido a la situación geopolítica de otras, el suministro es inestable. Se estima que el depósito más abundante contiene siete veces más la cantidad que se consume globalmente al año.[2] El total estimado en las reservas de los EE. UU. puede durar otros 20 años. Sin embargo, el helio es un elemento por lo que no lo podemos sintetizar para producir más cantidades. En tan solo unas cuantas décadas, hemos consumido la acumulación que se dio durante millones si no es que miles de millones de años, de este preciado elemento.
El helio es un elemento ligero que es único debido a que es un producto de la Tierra y no proviene de los restos de estrellas que existían antes de que la Tierra se formara. Todo el helio que existe en la Tierra se ha formado durante la historia del planeta.
¿Por qué la liberación de helio durante miles de millones de años no creó en la Tierra una atmósfera de helio? La masa de los átomos de helio es muy baja y son partículas que se mueven rápidamente en el aire. Todos aquellos átomos que estén a la altura suficiente y sean lo suficientemente rápidos, pueden escapar del jalón de la gravedad: El helio se fuga de la Tierra al espacio.
La mayor aplicación del helio es en la criogenia. El helio líquido es el ‘billete mágico’ para llegar al cero absoluto, la temperatura más baja posible. El helio se condensa a -269°C (4 K) y a esta temperatura, la mayoría de los metales se convierten en superconductores y permiten que una corriente eléctrica fluya con resistencia cero. Esto significa que el helio es la clave cuando se necesitan electromagnetos muy potentes.
Un ejemplo son los escáneres de imágenes por resonancia magnética (IRM). Hacen que los detalles en ligamentos rotos, tumores y defectos del corazón, sean visibles sin hacer cirugía, lo cual ha transformado los diagnósticos médicos. Estos escáneres usan aproximadamente del 30 al 35% del helio que se consume anualmente a nivel global[3,4] y son poco comunes en muchas partes del mundo, por lo que la demanda es probable que vaya a aumentar. ¿Conoces a alguien que se haya hecho un escaneo de IRM y que tal vez le haya salvado la vida? Esto no sería posible sin el helio.
En el mundo de la investigación científica, conocemos la estructura de las proteínas y de otras moléculas complejas gracias a los espectrómetros de resonancia magnética nuclear (RMN), que son parientes de los escáneres de IRM. Los aceleradores de partículas como los que se encuentran en el CERN, lugar de nacimiento de la red informática mundial y el sitio donde ocurre la caza del bosón de Higgs, también dependen de electromagnetos enormes que son enfriados con helio para guiar a las partículas cargadas.

Como el helio es un gas noble, es un gas inerte. Esto hace que sea útil en aplicaciones donde se necesita un ambiente no reactivo, por ejemplo en ciertos tipos de soldaduras y para purgar líneas de producción que contienen otras sustancias más reactivas. La fabricación de los semiconductores utilizados en los aparatos electrónicos depende del helio gracias a su naturaleza inerte y sus propiedades de fluido [5]
La inercia del helio también significa que no es una sustancia tóxica. Los buzos que bajan a grandes profundidades en el mar utilizan helio en la mezcla de aire de sus tanques, para reducir la cantidad de nitrógeno que se absorbe en la sangre durante buceos profundos. Cuando el nitrógeno se disuelve en la sangre, puede formar burbujas cuando el buzo sube a la superficie y causar enfermedad por descompresión, que es muy dolorosa y hasta puede ser mortal.
Finalmente, el tamaño tan pequeño de los átomos del gas helio hacen que se pueda colar por grietas de escala atómica. Esto lo hace muy útil en la investigación y a nivel industrial para detectar fugas.
Pues, tenemos un problema. La vida moderna depende del uso de un elemento que no solamente es finito, sino que se fuga de la Tierra y su consumo está sobrepasando sus reservas rápidamente. El decaimiento radiactivo en la Tierra sigue produciendo este gas mientras lees este artículo, pero se produce a una tasa que es mínima comparada con la tasa de su consumo.
El helio es un elemento clave para nuestras vidas, pero ¿cuántas personas lo saben?¿se necesita hacer más publicidad, junto con una campaña científica[6] para su conservación, reciclaje y reutilización?
Mientras tanto, el 17% de nuestro consumo global[4]se utiliza para llenar globos. Un gas tan importante y preciado se fuga al espacio y los globos se convierten en basura mientras ponen en peligro la vida silvestre[7] ¿Deberíamos preguntarnos si esto es ético? ¿En verdad vale la pena tener globos en una fiesta y causar la escasez del helio para las futuras generaciones?[8]
La autora se inspiró para escribir este artículo después de asistir a una apasionada conferencia del profesor David Cole-Hamilton, autor de la versión de la tabla periódica de los Elementos en Peligro.
[1] Un artículo en The Times sobre las muertes causadas por el mal uso del helio en el RU: https://www.thetimes.co.uk/article/more-than-500-deaths-are-linked-to-helium-misuse-226h83spt
[2] Un artículo sobre el descubrimiento de un depósito de helio: https://www.ox.ac.uk/news/2016-06-28-huge-helium-discovery-life-saving-find.
[3] Olafsdottir AH, Sverdrup HU (2020) Assessing the Past and Future Sustainability of Global Helium Resources, Extraction, Supply and Use, Using the Integrated Assessment Model WORLD7. Biophysical Economics and Sustainability 5:6. doi: 10.1007/s41247-020-00072-5.
[4] Más detalles acerca de los usos del helio en una tabla en la Ref. [3].
[5] Los usos del helio en aparatos electrónicos en esta presentación especial de gasworld: https://www.linde-gas.com/en/images/Gasworld%20Helium%20in%20Electronics%20January%202016_tcm17-419249.pdf.
[6] Un video en YouTube para generar conciencia sobre la conservación del helio: https://youtu.be/sHXu65zbpx8.
[7] Un artículo de la Royal Society of Chemistry sobre el helio y otros elementos en peligro: https://www.rsc.org/news-events/opinions/2019/jan/elements-in-danger/.
[8] El sitio web de la campaña en EE. UU. en contra de liberar globos y del mal uso del helio: https://balloonsblow.org/.
Helium Additional Material Spanish
Download this article as a PDF