En su elemento: las mujeres de la tabla periódica Understand article
Descubra cómo las mujeres científicas contribuyeron al conocimiento sobre los elementos químicos y lo que eso nos dice sobre la naturaleza del trabajo científico, en ese entonces y ahora.
En marzo de 1869, el químico ruso Dmitri Mendeleev presentó su sistema periódico a la Academia de Ciencias de Rusia (Gordin, 2004). Este sistema estaba basado en su idea de la ley periódica, una ley de la naturaleza que demostraba las regularidades de los elementos. El sistema de Mendeleev, ahora en su 150 aniversario, se ha mantenido firme frente a los nuevos desarrollos científicos, desde el descubrimiento de los gases nobles y los elementos radioactivos hasta el nuevo mundo de la física cuántica.
Sin embargo, la historia de la tabla periódica y sus elementos comenzó mucho antes de 1869, y la participación de las mujeres en este tema también. La historia de los distintos campos de la ciencia se suele contar desde el punto de vista de los conceptos y las teorías principales. A menudo se ignora el trabajo experimental y las observaciones inesperadas que llevan a esa comprensión teórica, pero justamente muchas mujeres contribuyeron de manera significativa a este aspecto relativamente desatendido. Para revertir esta tendencia, en el Año Internacional de la Tabla Periódicaw1 recordamos las historias de distintas mujeres científicas que han contribuido significativamente con su trabajo a nuestro conocimiento de los elementos de la tabla periódica.
El siglo XVIII
Marie-Anne Lavoisier y el nuevo concepto del elemento químico

Lavoisier y Antoine Lavoisier
(1788) (haga clic sobre la
imagen para ampliarla)
Jacques-Louis David, imagen
de dominio público
La reforma de la química que ocurrió en Francia en la década de 1780 suele considerarse el comienzo de la química moderna. En esa reforma, el aristócrata francés Antoine Lavoisier desempeñó un papel fundamental. En Méthode de nomenclature chimique (1787), Lavoisier y sus colaboradores les otorgaron nuevos nombres sistemáticos a todos los elementos conocidos y crearon una serie de reglas para nombrar los compuestos, que siguen siendo válidas en la actualidad. Además, Lavoisier estableció el concepto de elemento químico como sustancia simple (aquella que no puede descomponerse durante el análisis químico) y presentó una tabla de 33 elementos. Aunque no todos ellos se consideran elementos en la actualidad, la era de los cuatro elementos (tierra, aire, fuego y agua) había llegado a su fin.
En un cuadro famoso, Lavoisier está junto a su esposa, Marie-Anne: él está trabajando y ella posa como su musa inspiradora. Pero hay mucho más detrás de ese cuadro. Marie-Anne participó en el trabajo científico de Antoine: lo ayudaba en el laboratorio, lo asistía con su correspondencia, recibía a damas y caballeros extranjeros en su salón, traducía obras académicas en otros idiomas al francés e ilustraba libros científicos. También contribuyó a divulgar la química moderna (en particular, el elemento oxígeno) a través de la traducción y los comentarios críticos sobre el trabajo del químico irlandés Richard Kirwan que sostenía la teoría rival del flogisto.
El siglo XIX
Jane Marcet difunde el conocimiento sobre los elementos
En 1806, unas décadas después de la revolución química, una mujer suiza llamada Jane Marcet escribió un libro de texto de química que alcanzó las 16 ediciones británicas y al menos 23 estadounidenses y se tradujo al francés, alemán e italiano (Dreifuss & Sigrist, 2012).
Escrito en forma de diálogo y dirigido a las mujeres, el éxito de este popular libro de texto convirtió la química en un ilustre y distinguido tema de interés para el público general, incluidas las mujeres y las niñas. El material de Marcet estaba actualizado: recurrió a la tabla de los elementos de Lavoisier y también incluyó los metales alcalinos y alcalinotérreos descubiertos hacía poco (Na, K, Mg, Ca, Sr, Ba) que Humphry Davy había aislado. Además, mencionaba los elementos que Jöns Jacob Berzelius y sus estudiantes descubrieron o aislaron (Ce, Th, Se, Si, Zr, Li, La, Er, Tb, V), así como también los que descubrieron William Hyde Wollaston (Rh y Pd), Smithson Tennant (Os, Ir) y Charles Hatchett (el columbio, posteriormente conocido como Nb). Como miembro de la alta sociedad científica londinense, a través de sus contactos Marcet logró aportar una lista de elementos considerablemente más larga en comparación con la de Lavoisier. Aun así, ella estimó necesario publicar las primeras ediciones de su libro en forma anónima.
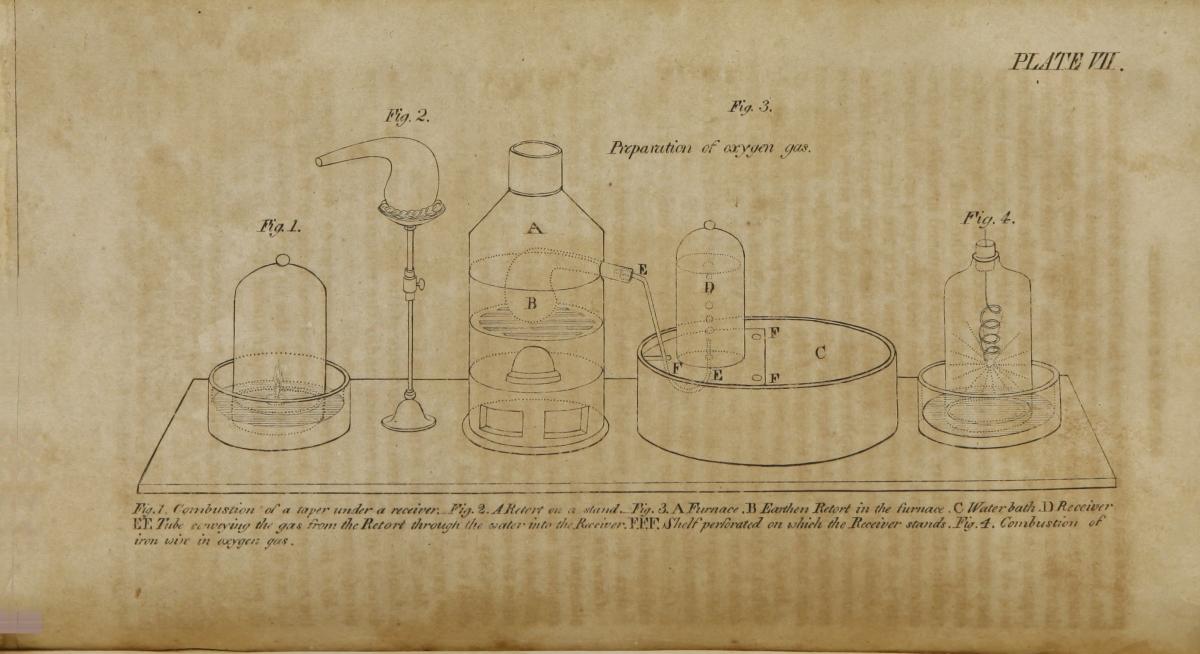
Biblioteca Nacional de Medicina de EUA/archive.org, imagen de dominio público
Julia Lermontova y los elementos del grupo de platino

A Karvain/Institut Mittag-
Leffler
La situación de Julia Lermontova era bastante diferente. En 1874, ella fue la primera mujer en Alemania (y una de las primeras del mundo) en doctorarse en química. Era contemporánea de Dmitri Mendeleev, se educó en Heidelberg con Robert Bunsen, trabajó con Wilhelm von Hoffman en Berlín y recibió su título de doctora en Gotinga. Lermontova se volcó a la química experimental y se dedicó a encontrar la ubicación correcta de los elementos del grupo del platino (Ru, Rh, Pd, Os, Ir, Pt) en el sistema periódico. Las propiedades y los pesos atómicos de estos elementos son muy parecidos, y la necesidad de obtener un peso atómico preciso requería que las sustancias se preparasen en su estado más puro. Para llevar a cabo esta tarea, era necesario repetir procedimientos analíticos precisos, de lo que solían ocuparse los «soldados rasos» como Lermontova. A menudo pasan al olvido las contribuciones de estos «soldados» (muchos de los cuales eran mujeres) que debían preparar los elementos puros o calcular los pesos atómicos precisos, pero permiten apreciar los verdaderos desafíos a los que se enfrentaban Mendeleev y sus contemporáneos al organizar todos los elementos conocidos en un sistema coherente. El trabajo no publicado de Lermontova permaneció desconocido para los historiadores durante mucho tiempo, pero fue redescubierto en los archivos de Mendeleev casi 100 años más tarde.
El siglo XX
Marie Curie y los elementos radiactivos

taller, c. 1900
Wellcome Collection, CC BY 4.0
El trabajo de Marie Curie es muy conocido y sigue despertando asombro: desde que descubrió el polonio y el radio junto a su esposo Pierre Curie y a su colega Gustave Bémont en 1898, Marie Curie y sus colaboradores han tenido que realizar análisis químicos meticulosos, usando toneladas de pechblenda para obtener 0.1 g de cloruro de radio en 1902 (Quinn, 1995). En este caso, la mujer del equipo, Marie, estaba casada con un científico, Pierre, pero estaban a cargo de proyectos de investigación independientes hasta que Pierre se dio cuenta del potencial del trabajo de Marie sobre la radiactividad y se unió a ella en el laboratorio. En esta historia, el personaje olvidado no es una mujer asistente, sino el químico Bémont.
Ida Noddack-Tacke y el renio

espectrómetro de rayos X en
el laboratorio, 1944
Universiteitsarchief Katholieke
Universiteit te Leuven
La química alemana Ida Noddack-Tacke se enfrentó al mismo agotamiento que Marie Curie cuando aisló uno de los metales más raros de la Tierra, el renio (Van Tiggelen, 2001). En 1925, Ida Tacke y su futuro esposo, Walter Noddack, con la ayuda de Otto Berg (otro personaje olvidado) anunciaron el descubrimiento del renio, pero les llevó tres años más obtener los primeros 120 mg de renio puro y lograron determinar su peso atómico por primera vez en 1929. Mientras tanto, la pareja había identificado las ubicaciones donde pensaban que había minerales ricos en renio, habían viajado a algunos de esos lugares y habían procesado miles de muestras minerales para aislar el elemento. Páginas y más páginas de notas de laboratorio son testigos de las tareas tediosas y repetitivas que no siempre proporcionaban los resultados que esperaban. Al igual que los Curie, los Noddack eran una pareja que colaboraba el uno con el otro, aunque la carrera de Ida permaneció financiera y académicamente a la sombra de la de su marido.
Stefanie Horovitz y la prueba de los radioisótopos
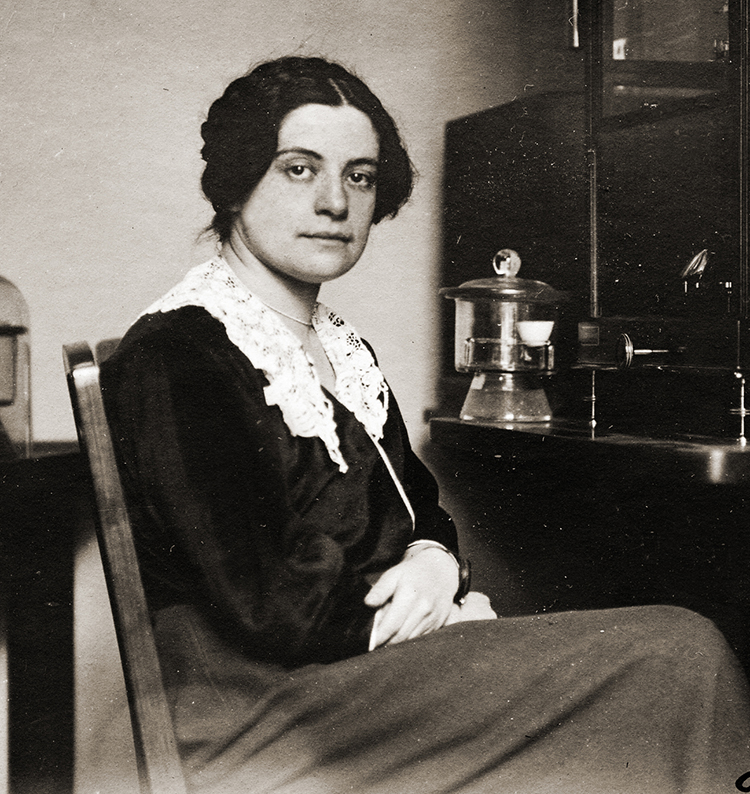
Instituto del Radio en Viena,
1915
Austrian Central Library for
Physics (Viena)
El trabajo de la química polaco-judía Stefanie Horovitz proporcionó la primera prueba fidedigna del concepto de los isótopos. En 1913, el químico británico Frederick Soddy había propuesto esta idea (que el mismo elemento podía tener diferentes pesos atómicos) usando un término acuñado por la doctora británica Margaret Todd. En ese entonces, se habían descubierto alrededor de 35 «elementos» radiactivos, muchos más que los espacios vacíos en el sistema periódico. El concepto de isótopos iba a solucionar ese problema creciente, ya que muchos de los nuevos elementos radiactivos luego resultaron ser isótopos de elementos conocidos. Sin embargo, al comienzo se recibió el concepto con escepticismo.
Para fortalecer la idea de los isótopos, Soddy propuso un punto de partida para la investigación experimental: si el plomo tenía diferentes isótopos, entonces se esperaría que el plomo derivado del uranio tuviera un peso atómico diferente del plomo común. En 1914, Otto Hönigschmid, el supervisor de la investigación, le asignó esa tarea a Horovitz en el Instituto del Radio en Viena. Horovitz pasó muchos días separando muestras puras de plomo de minerales radiactivos de uranio y tomando mediciones gravimétricas precisas para determinar su peso atómico. Su trabajo riguroso arrojó diferencias en el peso atómico que iban más allá del error experimental, lo que llevó a confirmar la existencia de los isótopos.
Además, Horovitz, junto a Hönigschmid, ayudó a probar que un supuesto nuevo elemento, el ionio, no existía, ya que demostró que tenía las mismas propiedades espectroscópicas y químicas que el torio y solo se diferenciaba del torio común por su peso atómico. Por lo tanto, se clasificó al ionio como un isótopo del torio (Th-230).
Ellen Gleditsch y los isótopos, más allá de los radioelementos

1927
Chris Koch
Aunque nació y se educó en Noruega, Ellen Gleditsch inicialmente adquirió experiencia en mediciones radiactivas capacitándose en el laboratorio de Marie Curie en París (Lykknes, 2005). Desde allí, pasó a la Universidad de Yale (Estados Unidos), donde gracias a su trabajo estableció un valor para el periodo de semidesintegración del «radio» (luego identificado como el isótopo del radio 226). Este valor, publicado en 1915, proporcionó una constante científica importante, ya que el radio era considerado la sustancia estándar en este campo de investigación.
Más tarde, en la Universidad de Harvard (Estados Unidos), Gleditsch, al igual que Horovitz, se volcó a la investigación de los isótopos. Se sabía que el peso atómico de los elementos radioactivos (o los que eran el resultado del decaimiento radiactivo) variaban de acuerdo a su fuente geológica. Por ejemplo, en minerales ricos en torio natural, la abundancia de plomo-208 aumentaba el peso atómico del plomo, mientras que en minerales ricos en uranio (en los que se produce el plomo-206), el peso atómico del plomo era menor. Se pensaba que esta variabilidad era cierta solo para elementos asociados con la radiactividad, no para los elementos comunes más livianos.
Pero ese supuesto comenzó a cuestionarse cuando en 1919 Francis Aston inventó el espectrógrafo de masa, que permitía una separación muy precisa de acuerdo al peso atómico y a la carga. Cuando Aston anunció que había encontrado dos pesos atómicos diferentes para el cloro (35 y 37) con un peso atómico promedio de 35.46, esto se recibió con escepticismo, ya que parecía que en este caso la composición isotópica también variaba con la fuente. Estaba en juego el concepto del peso atómico constante, sobre el que se basaba el sistema periódico.
Cuando Gleditsch y sus colaboradores analizaron el cloro proveniente de diferentes orígenes, encontraron que la composición isotópica del cloro, de hecho, no variaba de acuerdo a la fuente. En París, Irène Curie (hija de Pierre y Marie) había llegado a un resultado diferente, pero Gleditsch concluyó que las muestras de Curie probablemente habían estado contaminadas. Al fin y al cabo, el peso atómico del cloro era constante y se superó el obstáculo que enfrentaba el concepto del peso atómico estable.
Complejidad y colaboración
A lo largo de la historia del sistema periódico, las mujeres han contribuido a su ciencia: desde los salones del siglo XVIII como traductoras de trabajos científicos; autoras de libros de texto y divulgadoras de información; esposas, hermanas e hijas colaboradoras; como asistentes de investigación, maestras y profesoras; y en laboratorios, escuelas, casas e industrias (Watts, 2007). Las historias de las mujeres que aportaron nuevos conocimientos sobre los elementos muestran que el trabajo científico es complejo, multifacético y se basa en la colaboración. Por ello, tales historias no solo traen a la luz las contribuciones menos conocidas de las mujeres (y algunos hombres) a la ciencia: también expresan la verdadera naturaleza de la ciencia y el trabajo científico.
Agradecimientos
Las autoras desean agradecer a todos los autores que han aportado historias sobre las mujeres y los elementos en el libro Women in their Element: Selected Women’s Contributions to the Periodic System (Las mujeres en su elemento: contribuciones selectas de las mujeres al sistema periódico), publicado por World Scientific en agosto de 2019. Se agradece en especial a los siguientes autores: Patrice Bret y Keiko Kawashima; Gisela Boeck; Peter Childs; John Hudson; Marelene y Geoffrey Rayner-Canham; y Xavier Roqué.
References
- Dreifuss JJ, Sigrist NT (2012) The making of a bestseller: Alexander and Jane Marcet’s Conversations on Chemistry. In Lykknes A, Opitz DL, Van Tiggelen B (eds) For Better or For Worse? Collaborative Couples in the Sciences pp 19–32. Basel, Switzerland: Birkhäuser/Springer. ISBN: 3034802854
- Gordin MD (2004) A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table. New York, USA: Basic Books. ISBN: 046502775X
- Lykknes A (2005) Ellen Gleditsch: Professor, Radiochemist, and Mentor. PhD thesis, Department of Chemistry, Norwegian University of Science and Technology, Trondheim, Norway.
- Quinn S (1995) Marie Curie: A Life. Cambridge, USA: Perseus Books. ISBN: 0201887940
- Van Tiggelen B (2001) The discovery of new elements and the boundary between physics and chemistry in the 1920s and 1930s. The case of elements 43 and 75. In Reinhardt C (ed) Chemical Sciences in the 20th Century: Bridging Boundaries pp 131–145. Weinheim, Germany: Wiley-VCH. ISBN: 3527302719
- Watts R (2007) Women in Science: A Social and Cultural History. London, UK: Routledge. ISBN: 0415253071
Web References
- w1 – Las Naciones Unidas proclamó 2019 el Año Internacional de la Tabla Periódica de los Elementos Químicos. Puede leer el anuncio en el sitio web de las Naciones Unidas.
Resources
- Puede consultar más información sobre el Año Internacional de la Tabla Periódica de los Elementos Químicos en el sitio web IYPT2019.
- Puede leer más sobre Jane Marcet y su libro de texto en este artículo en Chemistry World.
- Puede leer la reseña biográfica de Marie Curie, Antoine Lavoisier y Jane Marcet en el sitio web del Science History Institute.
- Puede explorar la historia de la tabla periódica leyendo sobre algunas otras maneras de organizar los elementos. Consulte:
- Lorch M (2019) El ordenamiento de los elementos: el diseño cambiante de la tabla periódica. Science in School 47.
Review
Si se le solicita que nombren a mujeres que hayan contribuido al desarrollo de la tabla periódica, a mucha gente le sería difícil pensar en un nombre. Este artículo es una introducción breve pero fascinante al desarrollo de este increíble recurso, y destaca a muchas mujeres (y hombres) que han caído en el olvido, que hicieron mucho trabajo pero recibieron poco crédito.
El artículo resultaría útil como tema de discusión o lectura base de varios temas de química. Se puede trabajar transversalmente con otras áreas científicas en las que se ha pasado por alto el papel de las mujeres, como en la tecnología de la información, las matemáticas y la exploración del espacio. Sería ideal para una actividad de lectura estructurada o como ejercicio de comprensión. Se podrían plantear las siguientes cuestiones:
- Describe el papel de Marie-Anne Lavoisier en el establecimiento del concepto actual de elemento químico.
- Explica por qué el libro de texto de Jane Marcet logró la divulgación pública de los elementos químicos.
- ¿Por qué era una tarea tan difícil determinar el orden adecuado de algunos elementos?
Caryn Howard, jefa de química, St Mary’s School, Calne, Reino Unido
