Έξυπνα κινητά στο εργαστήριο : πόσο βαθύ είναι το μπλε σου ; Teach article
Eξερευνώντας την έγχρωμη χημεία με έξυπνα κινητά τηλέφωνα
Όταν ο χαλκός διαλύεται σε υδατικό διάλυμα νιτρικού οξέος, το διάλυμα γίνεται μπλε. Όσο περισσότερος χαλκός προστίθεται, τόσο πιο έντονο γίνεται το χρώμα. Αλλά πως μπορεί κάποιος να προσδιορίσει πόσος χαλκός έχει διαλυθεί απλά και μόνο παρατηρώντας το χρώμα ;
Είναι γνωστό ότι όταν διαλύεται ένα έγχρωμο σιρόπι, το χρώμα του ανοίγει. Αυτό συμβαίνει διότι η απορρόφηση της ακτινοβολίας, που δημιουργεί το χρώμα, είναι ανάλογη της συγκέντρωσης της διαλυμένης έγχρωμης ουσίας (σύμφωνα με τον νόμο των Beer – Lambert). Σε αυτή τη δραστηριότητα, μαθητές 13 – 18 ετών ελέγχουν αυτόν τον νόμο αξιοποιώντας ελεύθερες εφαρμογές χρωματικής αντιστοίχισης στα κινητά τους.

Αυτή η δραστηριότητα είναι κατάλληλη για ένα μάθημα χημείας, αλλά κατάλληλα διαμορφωμένη μπορεί να αξιοποιηθεί στα μαθηματικά. Αυτή η δραστηριότητα δίνει την ευκαιρία στους μαθητές να εφαρμόσουν την επιστημονική μέθοδο. Έχουν μία ερώτηση να απαντήσουν : πόσο χαλκό έχει διαλύσει ο καθηγητής ; Θα πρέπει να επιλέξουν ποια μέθοδο θα εφαρμόσουν πριν προχωρήσουν σε μετρήσεις, σε συγκέντρωση των δεδομένων, σε οργάνωση των δεδομένων σε πίνακα και σε χάραξη της γραφικής παράστασης προκειμένου να εκτιμήσουν την ποσότητα του διαλυμένου χαλκού.
Εδώ προτείνουμε τέσσερα διαφορετικά πρωτόκολλα :
- Ένα κλασσικό πρωτόκολλο βιβλίου μαγειρικής, που παρέχει όλες τις λεπτομέρειες σχετικά με τον τρόπο εκτέλεσής του.
- Ένα πρωτόκολλο για τα μαθηματικά, στο οποίο όλα τα διαλύματα έχουν προετοιμαστεί εκ των προτέρων : οι μαθητές κάνουν μόνο τις μετρήσεις και διενεργούν την ανάλυση.
- Ένα ανοιχτό πρωτόκολλο, στο οποίο οι μαθητές λαμβάνουν έναν μικρό αριθμό πληροφοριών και μία ερώτηση να απαντήσουν.
- Ένα συνεργατικό πρωτόκολλο, που προτείνει τη συνεργασία μεταξύ σχολείων.
Πρωτόκολλο χημικού βιβλίου συνταγών
Ο καθηγητής ή ο παρασκευαστής χρειάζεται να ετοιμάσει ένα διάλυμα χαλκού άγνωστης συγκέντρωσης τουλάχιστον μία ημέρα νωρίτερα (δείτε το κουτί). Μετά την παρασκευή του διαλύματος, οι μαθητές εκτελούν τη δραστηριότητα, που θα πρέπει να διαρκέσει περίπου 1,5 ώρα.
Ετοιμάζοντας το διάλυμα χαλκού άγνωστης συγκέντρωσης
Σημείωση για την ασφάλεια :
Το νιτρικό οξύ (ΗΝΟ3) είναι διαβρωτικό, για το λόγο αυτό χρησιμοποιείστε γάντια, γυαλιά και απαγωγό αερίων. Κατά την αντίδραση του χαλκού εκλύονται μεγάλες ποσότητες τοξικών αερίων και γι’ αυτό θα πρέπει η αντίδραση να πραγματοποιείτε στον απαγωγό αερίων τουλάχιστον μία ημέρα πριν.

Οι εικόνες είναι ευγενική προσφορά του Science on Stage
Υλικά
- 1.5–3.5 g καθαρού χαλκού
- 7.5–17.5 cm3 65% HNO3
- Απεσταγμένο νερό
- Ποτήρι 50 cm3
- Ογκομετρική φιάλη 100 cm3
Διαδικασία
- Πάρτε μία ποσότητα καθαρού χαλκού μεταξύ 1,5 g και 3,5 g (σημειώστε την ακριβή ποσότητα m(Cu)).
- Προσθέστε 5m(Cu) cm3 HNO3 σε ένα ποτήρι ζέσης των 50 cm3 (για παράδειγμα αν ζυγίσατε 2 g χαλκού, χρησιμοποιήστε 5 x 2 = 10 cm3 νιτρικού οξέος).
- Προσθέστε τον χαλκό (λίγο – λίγο αν είναι σε μορφή σκόνης), κλείστε τον απαγωγό αερίων και περιμένετε μέχρι να έχει διαλυθεί όλος ο χαλκός.
- Αφού έχει διαλυθεί πλήρως ο χαλκός, προσθέστε σταγόνα – σταγόνα 30 cm3 απεσταγμένου νερού, εν συνεχεία μεταφέρατε το διάλυμα σε μία ογκομετρική φιάλη των 100 cm3, αραιώστε με νερό μέχρι όγκου 100 cm3 και κλείστε τη φιάλη. Αναδεύστε καλά.
Δημιουργία κλίμακας αναφοράς
Υλικά
- 30 g ένυδρου νιτρικού χαλκού (Cu(NO3)2 3H2O)
- Απεσταγμένο νερό
- Τρεις ογκομετρικές φιάλες των 100 cm3
Διαδικασία
- Αριθμείστε τις φιάλες 1, 2 και 3
- Προσθέστε στις φιάλες 1, 2 και 3 αντίστοιχα 5, 10 και 15 g (Cu(NO3)2 3H2O). Υπολογίστε την ακριβή μάζα του καθαρού χαλκού σε κάθε φιάλη και σημειώστε τες ως m1, m2 και m3.
- Προσθέστε νερό μέχρι όγκου 100 cm3. Κλείστε τις φιάλες και αναδεύστε τες καλά. Έτσι θα έχετε τα νούμερα 1, 2 και 3 της κλίμακάς σας.
Σημείωση : Μπορείτε να αντικαταστήσετε τον Cu(NO3)2∙3H2O, που είναι ευαίσθητος στην υγρασία, με ένυδρο θειικό χαλκό (CuSO4·5H2O – μην αλλάξετε τις ποσότητες) ή με άνυδρο CuSO4 (σε αυτή την περίπτωση χρησιμοποιείστε περίπου 3.3 g, 6.6 g και 10 g).
Μετρήστε τις τιμές Η με ένα έξυπνο κινητό
Υλικά
-

Οι μαθητές μετρούν τις τιμές Η με έξυπνα κινητά
Οι εικόνες είναι ευγενική προσφορά του Science on StageΟι ογκομετρικές φιάλες 1 – 3 (από την διαδικασία ‘Δημιουργία κλίμακας αναφοράς’)
- Έξυπνα κινητά με εγκαταστημένες τις εφαρμογές Color Grab (android) ή ColorAssist Free Edition (iOS)w1
- Ένα μεγάλο φύλο λευκού χαρτιού
- Μολύβι
Διαδικασία
- Τοποθετήστε τη φιάλη Νο 1 μπροστά από ένα φύλο λευκού χαρτιού (το χαρτί θα πρέπει να στηρίζεται σε ένα κάθετο στήριγμα ούτως ώστε να δημιουργεί μία λευκή βάση και ένα λευκό φόντο) και με ένα μολύβι σημειώστε στο χαρτί την ακριβή θέση της φιάλης.
- Τοποθετήστε το κινητό σας στο τραπέζι έτσι ώστε το κέντρο της κάμερας να εστιάζει στο φαρδύτερο μέρος της φιάλης (η γωνία θέασης θα πρέπει να είναι οριζόντια). Η απόσταση ανάμεσα στο φόντο και τη φιάλη θα πρέπει να είναι περίπου 4 εκ. και ανάμεσα στο κινητό και τη φιάλη περίπου 14 εκ.
- Αξιοποιήστε την εφαρμογή του κινητού σας για να μετρήσετε την τιμή Η (του χρωματικού μοντέλου HSV ή HSL όπως εξηγείται στη συνέχεια του άρθρου) και καταγράψτε την τιμή.
- Επαναλάβετε την ίδια διαδικασία με τις φιάλες Νο 2 και 3.
Προσδιορισμός άγνωστου διαλύματος
- Με βάση τις τιμές m1, m2 και m3 που υπολογίστηκαν πριν σχεδιάστε τη γραφική παράσταση της τιμής Η σε συνάρτηση με την μάζα του χαλκού. Η τιμή Η είναι ανάλογη της συγκέντρωσης της διαλυμένης ουσίας, συνεπώς η γραφική παράσταση θα πρέπει να είναι ευθεία γραμμή.
- Εφαρμόζοντας το πρωτόκολλο όπως παραπάνω, υπολογίστε την τιμή Η του άγνωστου διαλύματος.
- Χρησιμοποιήστε τη γραφική παράσταση για να προσδιορίσετε τη μάζα του χαλκού στο άγνωστο διάλυμα του χαλκού.
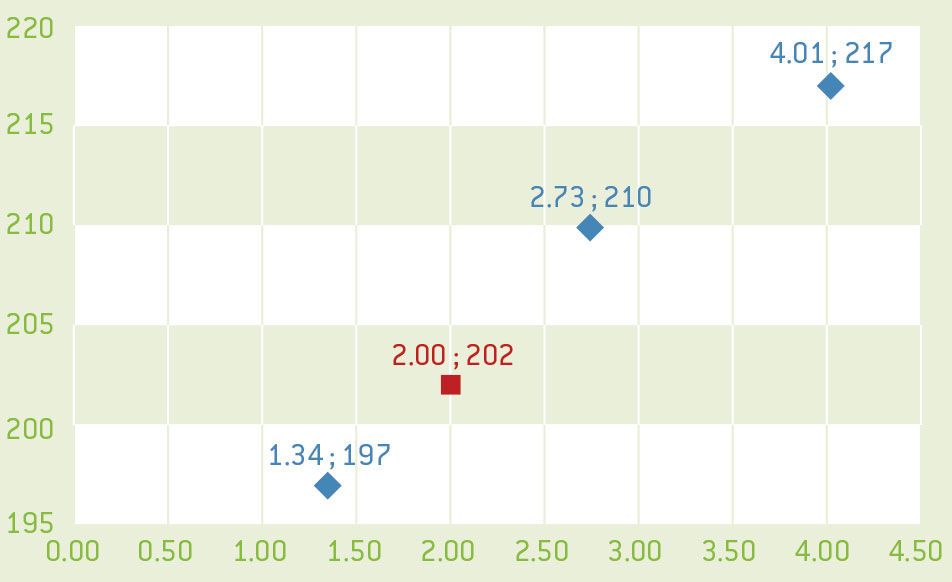
Οι εικόνες είναι ευγενική προσφορά του Science on Stage
Πρωτόκολλο μαθηματικών
Ο εκπαιδευτικός ετοιμάζει τα τέσσερα διαλύματα εκ των προτέρων και σημειώνει στις τρεις φιάλες με τα διαλύματα αναφοράς την ισοδύναμη μάζα καθαρού χαλκού. Θα πρέπει να έχει ετοιμαστεί ο εξοπλισμός που ίσως χρειαστούν ή ζητήσουν οι μαθητές. Το πείραμα θα πρέπει να ολοκληρωθεί εύκολα σε περίπου 45 λεπτά.
Διαδικασία
- Εγκαταστήστε μία από τις εφαρμογές χρωματικής αντιστοίχισης και αναζητήστε τον αποτελεσματικότερο τρόπο μέτρησης του χρώματος. Προσπαθήστε να μάθετε πως να σταματάτε την μέτρηση και πως να χρησιμοποιήσετε το φλας του κινητού βοηθητικά στις μετρήσεις σας.
- Μετρήστε τις τιμές Η των διαλυμάτων στις τρείς φιάλες, στις οποίες είναι σημειωμένες η μάζα του χαλκού που η καθεμία περιέχει.
- Σχεδιάστε τη γραφική παράσταση της σχέσης μεταξύ της τιμής Η και της μάζας του χαλκού. Όσο περισσότερο χαλκό περιέχει το διάλυμα τόσο πιο σκούρο είναι το χρώμα του.
- Μία τέταρτη φιάλη περιέχει μία άγνωστη ποσότητα χαλκού. Μετρήστε την τιμή Η αυτού του διαλύματος και με τη βοήθεια του γραφήματος προσδιορίστε τη μάζα του χαλκού στη φιάλη.
Ανοιχτό πρωτόκολλο
Ζητείστε από τους μαθητές σας να εγκαταστήσουν την εφαρμογή και εξηγείστε τους πως να την χρησιμοποιήσουν. Δώστε τους τις τρεις φιάλες με σημειωμένες τις μάζες του χαλκού και ζητήστε τους να επινοήσουν έναν τρόπο προσδιορισμού της μάζας του χαλκού στην τέταρτη φιάλη αξιοποιώντας την τιμή Η.
Επιλογή συνεργασίας
Οι μαθητές πραγματοποιούν το πείραμα και χρησιμοποιούν τα κινητά τους για να φτιάξουν ένα βίντεο όπου θα εξηγούν πως εκτελείται το πείραμα. Το βίντεο στέλνεται σε άλλο τμήμα (του ίδιου σχολείου ή άλλης χώρας), που θα πρέπει να ακολουθήσει το ίδιο πρωτόκολλο.

Πως δουλεύουν οι εφαρμογές
Οι εφαρμογές χρωματικής αντιστοίχισης μετρούν το χρώμα μέσω της κάμερας του κινητού και εκφράζουν τις τιμές του σε όρους του χρωματικού μοντέλου (RGB, HSV, LAB, κ.ά.). Κάτι τέτοιο είναι χρήσιμο όταν κάποιος θέλει να αγοράσει ένα συγκεκριμένο χρώμα για βάψιμο : μπορεί να μετρήσει το χρώμα με το κινητό του και να ζητήσει από το χρωματοπωλείο το ίδιο χρώμα.
Το σύστημα RGB είναι το συχνότερα χρησιμοποιούμενο χρωματικό μοντέλο (για παράδειγμα, είναι το μοντέλο που εφαρμόζεται στην απόδοση των χρωμάτων στην οθόνη του υπολογιστή σας), αλλά αυτές οι τιμές δεν έχουν κάποια σχέση με το μήκος κύματος του χρώματος. Αντ’ αυτού το σύστημα RGB χρησιμοποιεί ένα μόνο μήκος κύματος για καθένα από τα βασικά χρώματα. Η τιμή χροιάς (Η) του χρωματικού μοντέλου HSV ή HSL διακρίνει μεταξύ των διαφορετικών μπλε (μπλε μαρέν,, denim μπλε, κενταύριο μπλε, κ.λπ.). Η τιμή αυτή μπορεί να χρησιμοποιηθεί αντί της απορρόφησης για ένα συγκεκριμένο εύρος συγκεντρώσεων.
Παρ’ όλο που δεν δοκιμάστηκε, πιστεύουμε ότι η ίδια διαδικασία θα μπορούσε να εφαρμοστεί και σε άλλα έγχρωμα διαλύματα (π.χ. υπερμαγγανικό κάλιο ή διαλύματα χρωστικών τροφίμων). Θα πρέπει να προσδιοριστεί το εύρος των συγκεντρώσεων για τις οποίες η τιμή Η είναι ανάλογη με τη συγκέντρωση του διαλύματος.
Έγινε προσπάθεια να αξιοποιηθεί αυτή η διαδικασία στο γνωστό σε όλους πείραμα με το κόκκινο διάλυμα του κόκκινου λάχανου αλλά δεν δούλεψε καθώς τα μήκη κύματος των διαφόρων χρωμάτων του κόκκινου λάχανου δεν μεταβάλλονται γραμμικά με το pH. Η εφαρμογή δεν μπορούσε να διακρίνει τις αποχρώσεις μεταξύ pH 3 και 10, παρά μόνο τα βασικά χρώματα του κόκκινου λάχανου (ροζ, μωβ, πράσινο ή κίτρινο) και η εκτιμώμενη τιμή pH θα μπορούσε να ανήκει σε ένα μεγάλο εύρος πιθανών τιμών. Καθώς στο ίδιο συμπέρασμα καταλήγει κανείς και με το μάτι, δεν έχει νόημα η χρήση των έξυπνων κινητών γι’ αυτό το λόγο.
Ευχαριστίες
Αυτή η δραστηριότητα αναπτύχθηκε για πρώτη φορά στο πλαίσιο του προγράμματος Science on Stage και δημοσιεύθηκε στη συλλογή άρθρων του προγράμματος που αφορούσαν την εφαρμογή έξυπνων κινητών στην διδασκαλία των επιστημών, iStage 2w1. Σε ένα εργαστήριο στη Βιέννη της Αυστρίας – και αργότερα μέσω e-mail και της πλατφόρμας μάθησης ανοιχτού κώδικα, moodle – 20 εκπαιδευτικοί από 14 ευρωπαϊκές χώρες συνεργάστηκαν για να αναπτύξουν 11 διδακτικές ενότητες που παρουσιάζουν τρόπους αξιοποίησης των έξυπνων κινητών και των εφαρμογών τους στο μάθημα των μαθηματικών, της φυσικής, της χημείας ή της βιολογίας.
Το iStage2 παρέχει μία μοναδική περίληψη πρακτικών παραδειγμάτων από όλη την Ευρώπη για την ενσωμάτωση των έξυπνων κινητών στο καθημερινό μάθημα. Το φυλλάδιο αυτό αποτελεί την δεύτερη έκδοση της σειράς iStage που ασχολείται με νέα ψηφιακά μέσα σε τμήματα STEM. Είναι διαθέσιμο online και σε έντυπη μορφή στα Αγγλικά και στα Γερμανικά, με τη χρηματοδότηση της SAP. Εκτός από την έντυπη και την διαδικτυακή έκδοσή του, το φυλλάδιο μπορεί κάποιος να το κατεβάσει ως ibook.
Web References
- w1 – Όλα τα υλικά και τις εφαρμογές μπορεί να τα βρει κάποιος στην ιστοσελίδα του Science on Stage.
Institutions
Science on StageReview
Έχω παρακολουθήσει αυτή την παρουσίαση στο σχολείο μου από ένα από τους συγγραφείς, τον Marc Montanegro. Το άρθρο αποτελεί μία νέα προσέγγιση στη διδασκαλία του νόμου Beer – Lampert χωρίς φασματοφωτόμετρο – αντ’ αυτού χρησιμοποιείται ένα έξυπνο τηλέφωνο και ο απαραίτητος εξοπλισμός γίνεται απλούστερος. Παρ’ όλα αυτά, ένα ειδικό πρόγραμμα θα πρέπει να εγκατασταθεί σε όσα κινητά πρόκειται να χρησιμοποιηθούν.
Αυτή η δραστηριότητα θα μπορούσε να αποτελέσει το έναυσμα συζητήσεων κατά τη διδασκαλία της έννοιας του mol και της συγκέντρωσης. Τη σχέση ανάμεσα στο χρώμα και το μήκος κύματος. Το νόμο των Beer – Lambert. Και το ορατό φάσμα.
Maurice Cosandey, Ecole Polytechnique Fédérale de Lausanne, Ελβετία
